
| A、①② | B、只有④ |
| C、只有③ | D、③④ |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
 如图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一.
如图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一. 查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加酸或碱一定抑制水的电离 |
| B、加盐一定促进水的电离 |
| C、升高温度,水的pH值变小 |
| D、常温下任何稀的酸、碱、盐水溶液中KW=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系的压强不再改变 |
| B、混合气体密度不再改变 |
| C、反应速率3υA(正)=2υC(逆) |
| D、混合气体平均相对分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸的体积增大 |
| B、用小刀切割金属钠时,发现切面由银白色变暗 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠的表面发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、要实现Fe2+→Fe3+的转化,必须加入还原剂 |
| B、在反应CaH2+2H2O═Ca(OH)2+2H2↑,水作氧化剂 |
| C、反应2H2S+SO2═3S+2H2O中氧化剂和还原剂的物质的量之比是2:1 |
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2 NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:SiI4<SiBr4<SiCl4<SiF4 |
| B、沸点:H2S>H2O>HF>NH3 |
| C、熔点:金刚石>晶体硅>晶体锗>硫 |
| D、硬度:金刚石>白磷>冰>水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
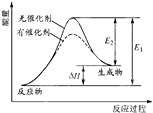 某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是( )
某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是( )| A、该反应为放热反应 |
| B、催化剂能改变该反应的焓变 |
| C、E1也可表示反应物断键需要吸收的总能量 |
| D、△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性 HClO4>HBrO4>HIO4 |
| B、碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 |
| C、稳定性 HCl>H2S>PH3 |
| D、氧化性 I>Br>Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com