
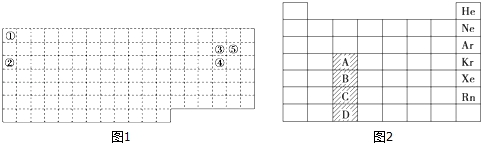
分析 由元素在周期表中位置,可知①为H、②为Na、③为O、④为S、⑤为F.
(1)同周期从左到右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,非金属性越强氢化物越稳定;
(2)②为Na,核素的化学符号AZX中左上角A为质量数,左下角Z为质子数,X为元素符号,且质量数=质子数+中子数;
(3)M、N两种化合物均由①②③④四种元素组成,此两种化合物在水溶液中发生反应,为NaHSO3与NaHSO4反应生成硫酸钠、二氧化硫与水;
(4)X、Y、Z代表原子序数依次增大的三种短周期元素,在周期表中,Y与X相邻,Y与Z也相邻,假设Y、Z、W处于同一周期,根据它们的原子序数依次增大,其最外层电子数分别设为x-1、x、x+1,则x-1+x+x+1=17,x为分数,不合理,假设不成立,三者不能处于同一周期,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: ,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理;
,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理;
(5)第四周期共有18种元素,而表中共有8个纵行,故A位置包含11种元素;C位于第六周期全部为金属元素.
解答 解:由元素在周期表中位置,可知①为H、②为Na、③为O、④为S、⑤为F.
(1)非金属性F>O>S,元素的非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>H2O>H2S,
故答案为:HF>H2O>H2S;
(2)②为Na,含有12个中子的核素的化学符号是:2311Na,
故答案为:2311Na;
(3)M、N两种化合物均由①②③④四种元素组成,此两种化合物在水溶液中发生反应,为NaHSO3与NaHSO4反应生成硫酸钠、二氧化硫与水,反应离子方程式为:H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(4)X、Y、Z代表原子序数依次增大的三种短周期元素,在周期表中,Y与X相邻,Y与Z也相邻,假设Y、Z、W处于同一周期,根据它们的原子序数依次增大,其最外层电子数分别设为x-1、x、x+1,则x-1+x+x+1=17,x为分数,不合理,假设不成立,三者不能处于同一周期,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: ,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,其中N元素不属于表中①~⑤中的元素,其处于周期表中:第二周期第ⅤA族,X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物为(NH4)2SO4,所含化学键类型为离子键、共价键,
,设X的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,X、Y、Z对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,其中N元素不属于表中①~⑤中的元素,其处于周期表中:第二周期第ⅤA族,X、Y、Z和①可组成一化合物,其原子个数比为2﹕4﹕1﹕8,该化合物为(NH4)2SO4,所含化学键类型为离子键、共价键,
故答案为:第二周期第ⅤA族;离子键、共价键;
(5)第四周期共有18种元素,而表中共有8个纵行,第四周期除A外每个位置只表示一种元素,故A位置包含11种元素;C位于第六周期全部为金属元素;
故答案为:11;是.
点评 本题考查元素周期表和元素周期律的综合知识,要求学生具有分析和解决问题的能力,(4)中关键是确定元素X、Y、Z的可能位置,利用最外层电子数之和推断,学习中注意积累相关知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
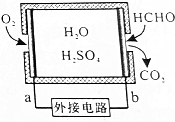
| A. | b为电池负极,甲醛被氧化 | |
| B. | a极的电极反应为O2+4e-+4H+=2H2O | |
| C. | 传感器工作过程中,电解质溶液中硫酸的浓度不变 | |
| D. | 当电路中转移1×10-4mol电子时,传感器内参加反应的HCHO为0.75mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 略大于20% | C. | 略小于20% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体直接通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 除去溴水中的少量溴化钠 | 加入乙醇,震荡,静置,分液,取出上层液体 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
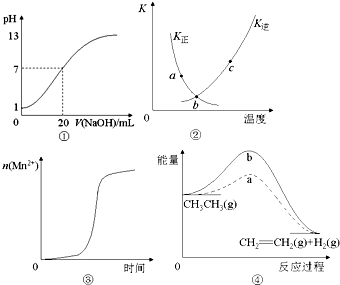
| A. | 图①表示25℃时,用0.1 mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1 盐酸溶液,溶液的pH随加入NaOH溶液体积的变化 | |
| B. | 图②中表示反应2SO2(g)+O2(g)?2SO3(g);△H<0的有关曲线,图中a.b.c三点中只有b点已经达到化学平衡状态. | |
| C. | 图③表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | |
| D. | 图④中a、b曲线分别表示反应CH3CH3→CH2=CH2 (g)+H2(g);△H>0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙处于同一周期 | |
| B. | 它们中有一种元素位于第ⅥA族 | |
| C. | 乙的最高价氧化物与甲的单质反应是吸热反应 | |
| D. | 简单甲离子的电子式为:Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有氢气生成的溶液中:Mg2+,Cl-,NO3-,K+ | |
| B. | 常温下,c(H+)=0.1 mol/L的溶液中:Na+,AlO2-、S2-、SO32- | |
| C. | 含有0.1 mol/LHCO3-的溶液:Na+,Fe3+,NO3-,SCN- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+,K+,CO32-,NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com