
【题目】某化学反应2A![]() B+C(吸热反应)分别在以下三种不同条件下进行,B、C的初始浓度为O,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示,容器容积恒定。
B+C(吸热反应)分别在以下三种不同条件下进行,B、C的初始浓度为O,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示,容器容积恒定。
根据上述数据,回答下列问题:
(1)在实验1、2中,实验2可能使用了_____,判断理由是___________。
(2)在实验1、3中,实验3比实验1达到平衡的时问较短,原因是__________。
(3)在实验2、3中,化学反应达到平衡时,实验3中c(A)较小的原因是__________。
(4)在实验2中,10~20min的平均反应速率v(B)=______mol·L-1·min-1。实验3达到平衡时,A的转化率为__________。
【答案】 催化剂 温度相同,A的起始浓度相同,实验2达到平衡时所用的时间比实验1短 其他条件不变时,温度升高,反应速率增大,达到平衡的时间缩短 其他条件相同,温度不同时反应的限度不同(其他合理答案也可) 0. 005 80%
【解析】(1)根据表中数据可知,实验2在20min时达到平衡状态,实验1在40min时,达到平衡状态,故实验2达平衡所需时间短,即实验2反应速率较快,因此实验2可能使用了使用催化剂加快反应速率;(2)根据表中数据可知,其他条件不变时,温度升高,反应速率增大,因此实验3比实验1达到平衡的时问较短;(3)根据表中数据可知,其他条件相同,温度不同时反应的限度不同,所以化学反应达到平衡时,实验3中c(A)较小;(4)在实验2中,10~20min的消耗A是0.1mol/L,则根据方程式可知生成B是0.05mol/L,所以平均反应速率v(B)= 0.05mol/L ÷10min=0.005mol·L-1·min-1。实验3达到平衡时消耗A是0.8mol/L,因此A的转化率为0.8/1/0×100%=80%。


科目:高中化学 来源: 题型:
【题目】检验1-溴丙烷中含有溴元素存在的实验步骤、操作和顺序正确的是:①加入AgNO3溶液②加入NaOH溶液③加入适量HNO3 ④加热 ⑤取上层液体 ⑥取下层液体
A. ②④⑤③① B. ②④⑥③① C. ②④⑤① D. ②④⑥①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,c(B-)=ymol·L-1,则Ksp值为
A. 1/2xy2 B. xy C. xy2 D. 4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 使用滴定管时,滴定管必须用待装液润洗2~3次
B. 滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高
C. 用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸
D. 稀释浓硫酸时,将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是( )
A.明矾可用作净水剂
B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多
D.铝制容器可长期存放酸性食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,不能达到预期目的是:
①苯、浓溴水、溴化铁混合制溴苯 ②苯酚浓溶液与稀溴水反应生成白色沉淀
③用溴水除去混在苯中的己烯,分液得到纯净的苯 ④乙醇和30%的硫酸共热到170℃制乙烯
A. ①②③④ B. ①②③ C. ①②④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸,;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应;石灰石与盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
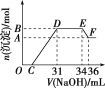
A.OC段反应离子方程式:H++OH-===H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(NH![]() )=0.012 mol
)=0.012 mol
D.欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com