
 ,Y
,Y ,Z
,Z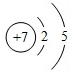 ,W
,W .
.分析 X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,以此解答该题.
解答 解:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素.
(1)由上述分析可知,X为钠,Y为碳,Z为氮,W为氯,故答案为:钠;碳;氮;氯;
(2)X为Na元素,质子数为11,核外电子数为11,有3个电子层,最外层1个电子,原子结构示意图为: ;
;
Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为 ;
;
Z为N元素,质子数为7,核外电子数为7,有2个电子层,最外层5个电子,原子结构示意图为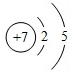 ;
;
W为Cl元素,质子数为17,核外电子数为17,有3个电子层,最外层7个电子,原子结构示意图为 ,
,
故答案为: ;
; ;
;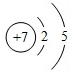 ;
; ;
;
(3)X为Na,位于周期表中第三周期ⅠA族;Y为碳,位于周期表中第二周期ⅣA族;Z为氮,位于周期表中第二周期ⅤA族;W为Cl元素,W位于周期表中第三周期ⅦA族,
故答案为:第三周期ⅠA族;第二周期ⅣA族;第二周期ⅤA族;第三周期ⅦA族;
(4)X的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HNO3,二者反应生成硝酸钠和水,反应的化学方程式为:NaOH+HNO3=NaNO3+H2O,
故答案为:NaOH+HNO3=NaNO3+H2O;
(5)X的最高价氧化物对应的水化物为NaOH,Y的最高价氧化物对应的水化物为H2CO3,Z的最高价氧化物对应的水化物为HNO3,W的最高价氧化物对应的水化物为HClO4,金属性越强,最高价氧化物对应的水化物碱性越强,非金属性越强,最高价氧化物对应的水化物酸性越强,所以碱性减弱、酸性增强的顺序为:NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH;H2CO3;HNO3;HClO4.
点评 本题考查元素周期表和周期律知识,正确推断元素的种类为解答该题的关键,注意掌握元素周期表结构、元素周期律的递变规律,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | +92 | B. | -345.3 | C. | -92 | D. | +345.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
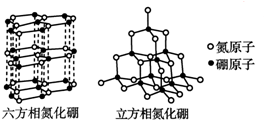 新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.
新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.5 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为1 NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6g Fe与足量稀盐酸反应,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
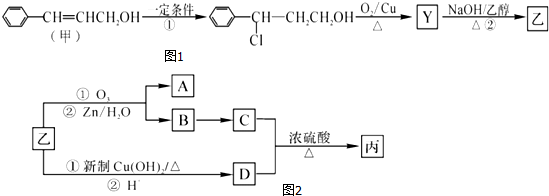
 .
. ;
; →Y:
→Y: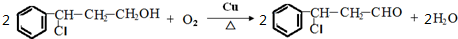 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
;

 .
. ,该物质在NaOH水溶液中加热反应时的化学方程式为
,该物质在NaOH水溶液中加热反应时的化学方程式为 +5NaOH$→_{△}^{H_{2}O}$
+5NaOH$→_{△}^{H_{2}O}$ +HOCH2CH2OH+Na2CO3+NaCl+2H2O.
+HOCH2CH2OH+Na2CO3+NaCl+2H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com