
(08年海南卷)(10分)A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R'为烷基)。

回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为_____________;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是___ 反应类型为_____:
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是__________________
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有__________种,其相应的结构简式是__________________。
答案:(1)C5H10O。
(2)HOOC―CH2―COOH;
HOOC―CH2―COOH + 2C2H5OH![]() C2H5OOC―CH2―COOC2H5 +2H2O;酯化反应(或取代反应)。
C2H5OOC―CH2―COOC2H5 +2H2O;酯化反应(或取代反应)。
(3)HO―CH2―CH2―CH=CH―CH3。
(4)2;CH3CH2CH2COOH、CH3CH(CH3)COOH。
解析:(1)氧的质量分数为1-0.814=0.186,假定A的相对分子质量为90,则N(O)==1.0463,所以氧的原子个数为1,则A的相对分子质量为:=86,由商余法得86-16/12=5……10,即A得分子式为C5H10O。
(2)由于B与NaHCO3溶液完全反应,其物质的量之比为1:2,所以B中含有2个-COOH,结合C+C2H5OH![]() C2H4O2+H2O可知,C为CH3COOH,即B中含有3个C原子,现已知B中含有2个-COOH,即B中还含有一个CH2,所以B的结构简式为HOOC-CH2-COOH,B与足量的C2H5OH反应的化学方程式为:HOOC―CH2―COOH + 2C2H5OH
C2H4O2+H2O可知,C为CH3COOH,即B中含有3个C原子,现已知B中含有2个-COOH,即B中还含有一个CH2,所以B的结构简式为HOOC-CH2-COOH,B与足量的C2H5OH反应的化学方程式为:HOOC―CH2―COOH + 2C2H5OH![]() C2H5OOC―CH2―COOC2H5 +2H2O,反应类型为酯化反应。
C2H5OOC―CH2―COOC2H5 +2H2O,反应类型为酯化反应。
(3)A可以与金属钠作用放出氢气,说明A中含有的官能团为-OH,能使溴的四氯化碳溶液褪色,说明A中含有C=C,且A为直链化合物,结合题上的提示可得A的结构简式为:
HO―CH2―CH2―CH=CH―CH3。
(4)能与NaHCO3溶液反应放出CO2,说明为羧酸,其结构简式为:CH3CH2CH2COOH、CH3CH(CH3)COOH。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年海南卷)(8分)反应A(g)+B(g) ![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
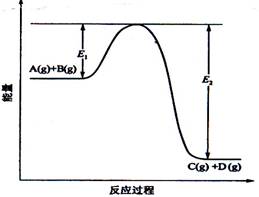
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年海南卷)(11分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号 | 内容 | 实验现象 |
1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐蚀中,负极反应是________________; 正极反应是_______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年海南卷)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A. 2mol B. 1 mol C. 0.5mol D. 0.25mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com