
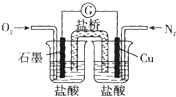
| A. | 石墨的电极反应:O2+2H20+4e-═4OH- | |
| B. | 此装置能将化学能转变为电能 | |
| C. | 电子由Cu电极经导线流向石墨电极 | |
| D. | 电池总反应:2Cu+O2+4HCl═2CuCl2+2H20 |
分析 A、装置中铜失电子被氧化,所以铜做负极,石墨做正极,酸性条件下不能生成氢氧根;
B、装置设计的是原电池反应,化学能转化为电能;
C、电子流向是铜电极流向石墨;
D、自发进行的氧化还原反应是铜在酸溶液中被氧气氧化生成氯化铜溶液.
解答 解:A、装置中铜失电子被氧化,所以铜做负极,石墨做正极,酸性条件下不能生成氢氧根,电极反应为O2+4H++4e-=2H2O,故A错误;
B、装置设计的是符合原电池反应的装置,化学能转化为电能,故B正确;
C、电子流向是负极铜电极流向正极石墨电极,故C正确;
D、自发进行的氧化还原反应是铜在酸溶液中被氧气氧化生成氯化铜溶液,反应的化学方程式2Cu+O2+4HCl=2CuCl2+2H2O,故D正确;
故选A.
点评 本题考查了原电池原理分析,注意把握原电池电极名称、电极反应、组成条件的理解应用,掌握原理是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
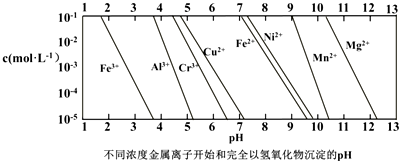
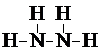 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
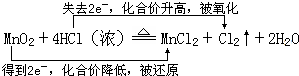
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 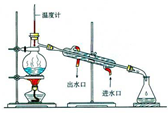 用如图装置分离甲苯和水 | |
| B. | 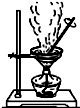 蒸干NH4Cl溶液制备NH4Cl晶体 | |
| C. | 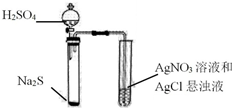 证明Ag2S溶解度小于AgCl | |
| D. | 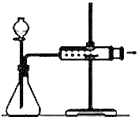 关闭分液漏斗活塞,向外拉动针筒活塞,松开后活塞恢复原位置,证明装置气密性良好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/106Pa | 1.01 | 2.02 | 40.4 |
| 平衡时c(A)/mol•L-1 | 0.022 | 0.05 | 0.075 |
| A. | ② | B. | ③④ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 | |
| B. | 25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH溶液与0.2 mol/L H2SO4恰好中和,所得溶液的pH<7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠浮在水面上 | B. | 金属钠形成小球状 | ||
| C. | 金属钠在水面上迅速游动 | D. | 反应后的溶液呈现红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com