
| A、标准状况下,2.24LCH4所含质子数为0.1NA |
| B、0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C、0.1mol C8H18分子中共价键总数为2.5NA |
| D、100mL 1mol/L醋酸溶液中离子总数为0.2NA |
| V |
| Vm |
| V |
| Vm |
| 2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
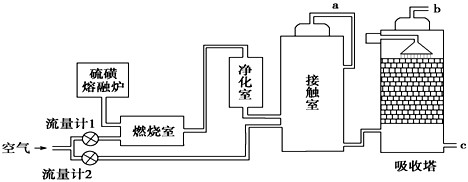
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ |
| B、2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C、在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
| D、1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
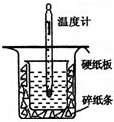 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题| 实验序号[来源:学#科#网] | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
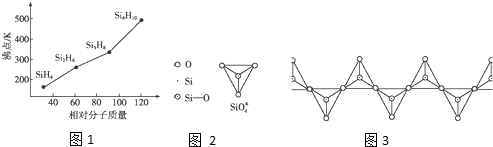
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.96g |
| B、4.68g |
| C、2.15g |
| D、3.78g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1mol?L-1明矾溶液50mL中滴入数滴0.1mol?L-1Ba(OH)2溶液Al3++2 SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| B、将1mol?L-1 NaAlO2溶液和1.5mol?L-1的HCl溶液等体积互相均匀混合6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| C、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| D、将少量CO2气体通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com