
��10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g)M(g)��N(g)������ʵ���������±���
| ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
| n(X) | n(Y) | n(M) | ||
| �� | 700 | 0.40 | 0.10 | 0.090 |
| �� | 800 | 0.10 | 0.40 | 0.080 |
| �� | 800 | 0.20 | 0.30 | a |
| �� | 900 | 0.10 | 0.15 | b |
����˵����ȷ����(����)
A��ʵ����У���5 minʱ���n(M)��0.050 mol����0��5 min ʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol·L��1·min��1
B��ʵ����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C��ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D��ʵ����У��ﵽƽ��ʱ��b��0.060
�𰸡�C
������A����ݷ���ʽ��֪��5 min�ڷ�Ӧ���ɵ�n(N)�������ɵ�n(M)����v(N)��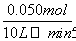 ��1��10��3 mol·L��1·min��1���������B����ݱ��������ݿ�֪ƽ��ʱc(X)��0.002 mol·L��1��c(Y)��0.032 mol·L��1��c(N)��c(M)��0.008 mol·L��1����ƽ�ⳣ��K��
��1��10��3 mol·L��1·min��1���������B����ݱ��������ݿ�֪ƽ��ʱc(X)��0.002 mol·L��1��c(Y)��0.032 mol·L��1��c(N)��c(M)��0.008 mol·L��1����ƽ�ⳣ��K��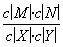 ��
��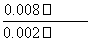 ��1.0���������C���÷�Ӧ��800 ��ʱƽ�ⳣ��Ϊ1.0���跴Ӧ��ת����X�����ʵ���Ϊx������(0.20��x)��(0.30��x)��x·x����x��0.12 mol��X��ת����Ϊ
��1.0���������C���÷�Ӧ��800 ��ʱƽ�ⳣ��Ϊ1.0���跴Ӧ��ת����X�����ʵ���Ϊx������(0.20��x)��(0.30��x)��x·x����x��0.12 mol��X��ת����Ϊ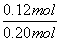 ��100%��60%��������ȷ��������900 ��ʱ���÷�Ӧ��ƽ�ⳣ��ҲΪ1.0������ʵ����е����ݿ�֪b��0.060���ɢ������ݿ�֪��700 ��ʱƽ�ⳣ��ԼΪ2.6�����800 ��ʱƽ�ⳣ��Ϊ1.0��֪���¶�Խ�ߣ���ƽ�ⳣ��ԽС��ƽ�������ƶ�����b<0.060���������
��100%��60%��������ȷ��������900 ��ʱ���÷�Ӧ��ƽ�ⳣ��ҲΪ1.0������ʵ����е����ݿ�֪b��0.060���ɢ������ݿ�֪��700 ��ʱƽ�ⳣ��ԼΪ2.6�����800 ��ʱƽ�ⳣ��Ϊ1.0��֪���¶�Խ�ߣ���ƽ�ⳣ��ԽС��ƽ�������ƶ�����b<0.060���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ����ȷ����(����)
A��ʯӢ���ռӦ��SiO2��2OH��===SiO ��H2O
��H2O
B�������ռӦ��Si��2OH��===SiO ��H2��
��H2��
C����������Һ��ͨ������CO2��SiO ��CO2��H2O===CO
��CO2��H2O===CO ��H2SiO3��
��H2SiO3��
D����ˮ�����м������2H����SiO ===H2SiO3��
===H2SiO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijУ��ѧʵ����ȤС����������ͼ��ʾ��ʵ��װ���Ʊ�Cl2��ͬʱ�����������йص�ijЩʵ�飬��Ҫ��ش����⡣
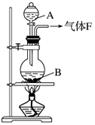
(1)A��Ũ���ᣬB�Ƕ������̣���A����B��ʱ������Ӧ�����ӷ���ʽΪ______________��
(2)��ͬѧ�ú���0.2 mol HCl��Ũ������������MnO2��Ӧ��Cl2������Ƶõ�Cl2����ڱ�״����С��1.12 L���������ڷ�Ӧ����������Ũ�ȱ�С��ɵġ����оٵ�������Ũ�ȱ�С��ԭ��__________��
(3)��ʵ�����У���ͬѧ������ͼ�е�װ�þ�����������ƿ�٢���Ӧʢ�ŵ��Լ��ֱ��Ǣ�__________����______(���Լ�����)��
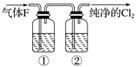
(4)��ͬѧ��������Cl2ͨ��һ����ʯ����������ȡƯ�ۣ���ͨ��224 mL��״����Cl2��ȫ��Ӧʱ����Ӧ������ת�Ƶ��ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����N2(g)��3H2(g)2NH3(g)��K1
2NH3(g)N2(g)��3H2(g)��K2
�Էֱ�д��ƽ�ⳣ������ʽ�����ж����ϵ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
SO2�����������ᣬ����һ����Ҫ�ķ�ӦΪ2SO2(g)��O2(g)2SO3(g)����H��0������һ��2 L���ܱ������г���0.4 mol SO2��0.2 mol O2��0.4 mol SO3������������Ӧ��
��ش��������⣺
(1)����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ�����________(����ĸ)��
A��c(SO2)��0.3 mol·L��1��c(O2)��0.15 mol·L��1
B��c(SO3)��0.4 mol·L��1
C��c(O2)��0.2 mol·L��1��c(SO2)��0.4 mol·L��1
D��c(SO3)��0.3 mol·L��1
(2)��ѡ����һ�ֿ��ܵ����������ﵽƽ��ʱ��ƽ�ⳣ��Ϊ________��
(3)ij�¶�ʱ����4 mol SO2��2 mol O2ͨ��2 L�ܱ������У�10 minʱ��Ӧ�ﵽƽ�⣬SO2��ת����Ϊ80%����0��10 min�ڵ�ƽ����Ӧ����v(O2)��________�����¶��·�Ӧ2SO2(g)��O2(g)2SO3(g)��ƽ�ⳣ��K��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣺
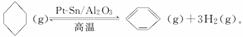 ��ij�¶��£�������ܱ������м��뻷���飬����ʼŨ��Ϊa mol·L��1��ƽ��ʱ����Ũ��Ϊb mol·L��1���÷�Ӧ��ƽ�ⳣ��K��________��
��ij�¶��£�������ܱ������м��뻷���飬����ʼŨ��Ϊa mol·L��1��ƽ��ʱ����Ũ��Ϊb mol·L��1���÷�Ӧ��ƽ�ⳣ��K��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��300 mL���ܱ������У��������۲�����һ������CO���壬һ�������·�����Ӧ��Ni(s)��4CO(g)Ni(CO)4(g)����֪�÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���±���
| �¶�/�� | 25 | 80 | 230 |
| ƽ�ⳣ�� | 5��104 | 2 | 1.9��10��5 |
����˵������ȷ����(����)
A����������Ni(CO)4�ķ�ӦΪ���ȷ�Ӧ
B��25 ��ʱ��ӦNi(CO)4(g)Ni(s)��4CO(g)��ƽ�ⳣ��Ϊ2��10��5
C����80 ��ʱ�����ijʱ��Ni(CO)4��CO��Ũ�Ⱦ�Ϊ0.5 mol·L��1�����ʱv����v��
D��80 ��ﵽƽ��ʱ�����n(CO)��0.3 mol����Ni(CO)4��ƽ��Ũ��Ϊ2 mol·L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���Ԫ�أ���ԭ�Ӱ뾶���μ�С��Ԫ�ص�һ�����������ߵ�˳�����е���(����)
A��K��Na��Li B��Al��Mg��Na
C��N��O��C D��Cl��S��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����и��������У��Է����ж������������Һ����
��Cl2��N2����SiH4��CH4����SO2��CO2�����ڶ��ױ����Զ��ױ����ݼ��顢���顡���顢�춡��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com