
| A. | 该元素原子的最外层电子数 | |
| B. | 化合时该元素的一个原子得到的电子数 | |
| C. | 该元素一个原子结合其他元素原子的个数 | |
| D. | 该元素一个原子与其他原子形成共用电子对的数目 |
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -=Fe2+ | |
| C. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①CO2(g)+C(s)═2CO(g)△H1
已知:①CO2(g)+C(s)═2CO(g)△H1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的一个分子中有32个氢原子 | B. | X的一个分子中含有三个 | ||
| C. | X是一种醇 | D. | X不能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
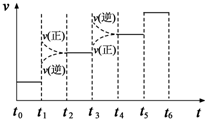 氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0
氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com