
分析 (1)根据同一反应在相同条件下,同一时间段内用各种物质表示的化学反应速率=化学计量数之比;
(2)根据2min末,HI的浓度为v(HI)×2min可得;
(3)根据生成的HI的浓度计算参与反应的氢气和碘单质的浓度,氢气碘单质的初始浓度可得.
解答 解:(1)同一反应在相同条件下,同一时间段内用各种物质表示的化学反应速率=化学计量数之比,则有υ(H2)=υ(I2)=$\frac{1}{2}$×υ(HI)=$\frac{1}{2}$×0.1mol/(L•min)=0.05 mol•L-1•min-1;
故答案为:0.05 mol•L-1•min-1;0.05 mol•L-1•min-1
(2)2min未,c(HI)=v(HI)×2min=0.1mol/(L•min)×2min=0.2mol/L;
故答案为:0.2;
(3)由(2)知生成的HI的浓度为0.2mol/L,则反应了I2为$\frac{1}{2}$×0.2mol/L=0.1mol/L,2min末,I2(g)的物质的量浓度为0.4mol/L,则I2的初始浓度为0.1mol/L+0.4mol/L=0.5mol/L,H2(g)和I2(g)等量,则氢气的初始浓度也为0.5mol/L;
故答案为:0.5;0.5.
点评 本题考查了化学平衡、化学反应速率的计算,题目难度中等,注意掌握化学反应速率与化学计量数的关系,明确化学反应速率的概念及计算方法,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | H2SO4和H3PO4的摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: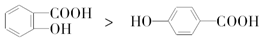 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶于水 | B. | 此AgCl更难溶于水 | ||
| C. | 与AgCl一样难溶于水 | D. | 无法确定溶解性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Mg2+、OH- | B. | MnO4-、K+、CO32-、Na+ | ||
| C. | K+、SO42-、HCO3-、Na+ | D. | NH4+、SO42-、K+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com