
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | NO2、CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氢氧化钠溶液,纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
分析 A、酸性氧化物是与碱反应生成盐和水的反应;
B、过氧化钠与二氧化碳反应生成碳酸钠和氧气,而氧化钠与二氧化碳反应生成碳酸钠;
C、一氧化氮与氧气生成二氧化氮;
D、NaOH、碳酸钠溶液都呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠.
解答 解:A、SiO2与氢氧化钠反应生成硅酸钠和水,SO2与氢氧化钠反应生成亚硫酸钠和水,都生成盐和水,故A正确;
B、过氧化钠与二氧化碳反应生成碳酸钠和氧气,而氧化钠与二氧化碳反应生成碳酸钠,所以两者与二氧化碳反应产物不同,故B错误;
C、一氧化氮与氧气生成二氧化氮,所以一氧化氮不稳定,故C错误;
D、NaOH、碳酸钠溶液都呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠,从而打不开瓶塞,所以氢氧化钠、纯碱溶液要存放在带橡胶塞的试剂瓶中,故D错误;
故选A.
点评 本题考查酸性氧化物、过氧化钠和氧化钠的性质比较、一氧化氮的还原性和盐的水解,明确物质的性质即可解答,侧重考查学生分析、对比能力,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 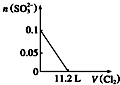 | B. | 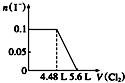 | C. | 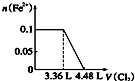 | D. | 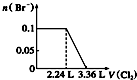 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,4.6g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| B. | 25℃时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.01NA | |
| C. | 1L 0.1mol•L-1 K2CO3溶液中,阴离子数目大于0.1NA | |
| D. | 2molSO2和1molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤⑥ | C. | ②④⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
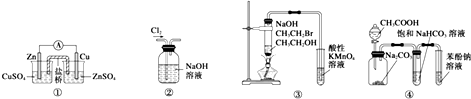
| A. | 装置①:构成锌-铜原电池 | |
| B. | 装置②:除去Cl2中含有的少量HCl | |
| C. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 装置③:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Fe3+ | C. | Fe2+、NH4+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2 | |
| B. | 由CO2+Ca(ClO)2+H2O═CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O═CaSO3↓+2HClO | |
| C. | 铝和硫直接化合能得到Al2S3,推测:铁和硫直接化合也能得到 Fe2S3 | |
| D. | 由Na2CO3+2HCl═2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl═2NaCl+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
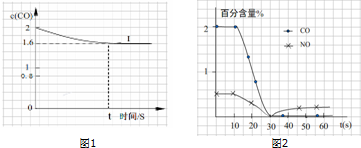
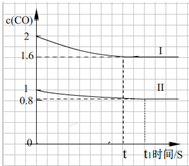 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com