
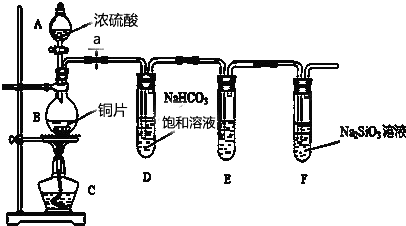
分析 (1)A名称是分液漏斗;
(2)连接好仪器后,要检验装置气密性,然后装药品;
(3)①铜和浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化;
②元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其非最高价氧化物的水化物酸性强弱判断非金属性强弱.
解答 解:(1)A名称是分液漏斗,故答案为:分液漏斗;
(2)连接好仪器后,要检验装置气密性,然后装药品,否则易导致实验失败,故答案为:检验装置气密性;
(3)①铜和浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液除去二氧化硫气体,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;除去二氧化硫气体;
②元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,所以可以根据强酸制取弱酸判断非金属性强弱,其离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,
故答案为:强酸制取弱酸;CO2+SiO32-+H2O=H2SiO3↓+CO32-;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其非最高价氧化物的水化物酸性强弱判断非金属性强弱,亚硫酸不是S元素的最高价氧化物的水化物,所以不能据此判断非金属性强弱,
故答案为:否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物).
点评 本题以浓硫酸和铜反应为载体考查性质实验方案设计,明确实验原理及物质性质是解本题关键,知道操作步骤、实验目的及物质性质即可解答,注意不能根据亚硫酸的酸性强弱判断S元素非金属性强弱,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳单键数为0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | 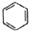 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$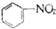 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$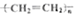 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.
某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com