
【题目】Ⅰ书写下列物质的电子式:
O2:______________ N2:____________ .Cl2:______________H2O:____________. NaOH:___________Na2O2:___________.
Ⅱ 写出下列电极反应式:
(1)碱性锌锰电池负极反应式:____________________________________.
(2)铅蓄电池的负极反应式:___________________________________________.
(3)氢氧燃料电池酸性介质的负极反应式:_______________________________.正极反应式:_______________________________.
【答案】![]()
![]()
![]()
![]()
![]()
![]() Zn+2OH--2e-=Zn(OH)2 Pb+SO42--2e-=PbSO4 2H2-4e-=4H+ O2+4H++4e-=2H2O
Zn+2OH--2e-=Zn(OH)2 Pb+SO42--2e-=PbSO4 2H2-4e-=4H+ O2+4H++4e-=2H2O
【解析】
I.O2中两个O原子共用2对电子,使每个O原子都达到8个电子稳定结构;
N2中两个N原子共用3对电子,使每个N原子都达到8个电子稳定结构;
Cl2中两个Cl原子共用1对电子,使每个Cl原子都达到8个电子稳定结构;
H2O中两个H原子与O原子共用2对电子,使每个原子都达到稳定结构;
NaOH中Na+与OH-通过离子键结合,OH-中O原子与H原子形成1对共用电子;
Na2O2中2个Na+与O22-通过离子键结合,O22-中2个O原子形成1对共用电子;
II. (1)碱性锌锰电池中,Zn作负极,失去电子,变为Zn2+与溶液中的OH-变为Zn(OH)2;
(2)铅蓄电池中Pb失去电子变为Pb2+,与溶液中的SO42-转化为PbSO4;
(3)氢氧燃料电池在酸性介质H2失去电子变为H+,正极上O2获得电子变为H2O。
I.原子最外层有6个电子,O2中两个O原子共用2对电子,使每个O原子都达到8个电子稳定结构,电子式为:![]() ;
;
N原子最外层有5个电子,N2中两个N原子共用3对电子,使每个N原子都达到8个电子稳定结构,其电子式为:![]() ;
;
Cl原子最外层有7个电子,Cl2中两个Cl原子共用1对电子,使每个Cl原子都达到8个电子稳定结构,电子式为![]() ;
;
H2O中两个H原子与O原子共用2对电子,使每个原子都达到稳定结构,H2O分子的电子式为:![]() ;
;
NaOH中Na+与OH-通过离子键结合,OH-中O原子与H原子形成1对共用电子,电子式为:![]() ;
;
Na2O2中2个Na+与O22-通过离子键结合,O22-中2个O原子形成1对共用电子,电子式为![]() ;
;
II. (1)碱性锌锰电池中,Zn作负极,失去电子,变为Zn2+与溶液中的OH-变为Zn(OH)2,负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2
(2)铅蓄电池中Pb失去电子变为Pb2+,与溶液中的SO42-转化为PbSO4,负极的电极反应式为:Pb+SO42--2e-=PbSO4;
(3)氢氧燃料电池在酸性介质H2失去电子变为H+,负极的电极反应式为:2H2-4e-=4H+;正极上O2获得电子变为O2-,与溶液中的H+结合变为H2O,正极的电极反应式为:O2+4H++4e-=2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A. 原子半径:X>Y>Z>WB. 原子序数:Y>X>Z>W
C. 原子最外层电子数:Z>W>Y>XD. 金属性:X>Y,还原性:W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中,能大量共存的离子组是( )
A.Cu2+、Na+、SO42-、Cl﹣B.Ba2+、Na+、OH﹣、SO42-
C.OH﹣、HCO3﹣、Ca2+、Na+D.K+、Na+、OH﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种不溶性盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

请回答:
(1)X除了含有H、O元素外,还有___元素(填元素符号)。
(2)混合气体通入溴水中发生反应③的离子方程式________。
(3)写出X的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
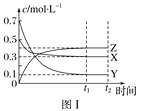
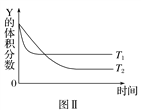
A. 该反应的热化学方程式为X(g)+3Y(g) ![]() 2Z(g) ΔH>0
2Z(g) ΔH>0
B. 若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C. 温度分别为T1和T2时的平衡常数大小关系为K2>K1
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的实验,他们提出下列实验方案。
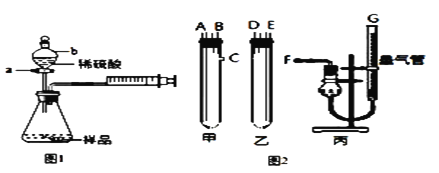
(1)甲同学用图1装置,把m g的混合物样品与足量稀硫酸反应后,测定产生的CO2气体的体积,检查该装置的气密性时,某同学将注射器活塞拉出一定距离,___,说明该装置的气密性好;当锥形瓶内不再产生气泡时立即读数,测定结果 ___(填 “偏大”、“偏小”、“无影响”)。
(2)乙同学用图2装置,Na2CO3、NaCl的固体混合物样品和稀硫酸应分别置于甲和乙中,导管连接方式如下:A连接____,B连接____,C连接_____(填写各接口的字母编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是 ( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.用酒精萃取溴水中的溴单质的操作可选用分液漏斗而后静置分液
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol X气体和1mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),2min内生成0.4mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.2mol·L-1·min-1,试计算:
(1)前2min内,用X表示的平均反应速率______;
(2)化学方程式中Z的化学计量数n______;
(3)2min内Y的转化率______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在有机化合物中,每个碳原子周围都有4对共用电子对
B.在有机化合物中,碳原子能形成单键、双键、叁键,还可形成其它形式的共价键
C.在有机化合物中,碳、氢原子之间只能形成单键
D.在有机化合物中,碳、氮原子之间只能形成单键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com