
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
分析 A、根据弱电解质的电离平衡来分析稀释后的pH;
B、根据离子对氨水的电离平衡的影响来分析平衡移动及溶液的pH;
C、物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),以此分析;
D、pH=5.6,说明c(H+)>c(OH-),据电荷守恒分析.
解答 解:A、因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故A错误;
B、在氨水中存在电离平衡,当加入NH4Cl,平衡逆向移动,氢氧根离子的浓度减小,由酚酞的变色范围8.2~10可知,此时溶液的pH可能小于8.2,不一定小于7,故B错误;
D、物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C正确;
D、pH=5.6,说明c(H+)>c(OH-),据电荷守恒c(CH3COO-)>c(Na+),故D错误;
故选C.
点评 本题考查了电离平衡及pH的有关计算,学生应注意酸的溶液的pH在常温下一定小于7,能利用影响平衡的因素及酸碱反应的实质来分析解答即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
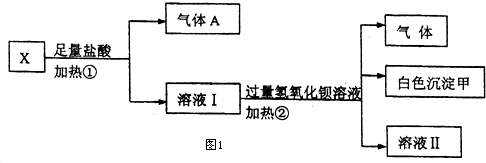
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
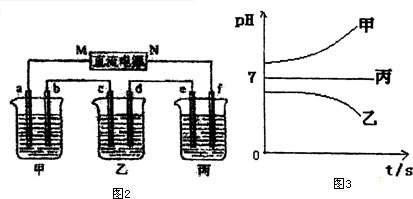
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g),△H<O;升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
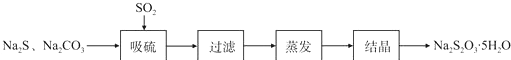
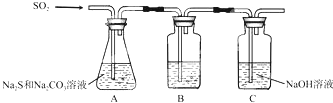
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. 按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸.
按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸. .试剂c最好选用C(填字母序号).
.试剂c最好选用C(填字母序号). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com