
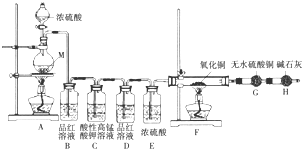
分析 金属与浓硫酸反应,开始生成的是二氧化硫,如果金属过量,浓硫酸变成稀硫酸后,如果金属较活泼,则可能还生成氢气;
(1)如果有氢气存在,氢气能够还原氧化铜生成铜;铜与浓硫酸加热生成硫酸铜、二氧化硫和水;
(2)若D瓶品红溶液无颜色变化,F管中黑色粉末变成红色,G干燥管里白色粉末变蓝色,说明生成氢气;
则金属活泼性顺序排在氢前面;C中二氧化硫被酸性高锰酸钾吸收发生氧化还原反应;
(3)反应物中有浓硫酸,根据稀释浓硫酸的方法进行解答,注意稀释前先冷却,然后将混合液加入烧杯中;
(4)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色,说明溶液中含有三价铁离子;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去,说明溶液中含有二价铁离子,然后根据质量守恒定律、得失电子守恒书写方程式.
解答 解:当金属过量时,且金属较活泼则生成的气体中可能含有氢气,所以假设2为:气体产物有SO2和H2 ,故答案为:气体产物有SO2和H2 ;
(1)如果有氢气存在,氢气能够还原氧化铜生成铜,F中黑色固体变红,若B瓶里品红溶液褪色,E、F和G中都无明显现象,说明不含氢气,故1正确;铜与浓硫酸加热生成硫酸铜、二氧化硫和水,方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)若D瓶品红溶液无颜色变化,F管中黑色粉末变成红色,G干燥管里白色粉末变蓝色,说明生成氢气;
则金属活泼性顺序排在氢前面,则M可以是铁、镁、锌、铝等(填一个即可)的任意一种;
C瓶中二氧化硫被高锰酸钾氧化,离子方程式:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(3)可以类比稀释浓硫酸的方法进行操作,方法为:先将烧瓶中混合溶液冷却,再将混合液慢慢加入盛水的烧杯里,并不断搅拌,
故答案为:先将烧瓶中混合溶液冷却,再将混合液慢慢加入盛水的烧杯里,并不断搅拌;
(4)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色,说明溶液中含有三价铁离子;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去,说明溶液中含有二价铁离子,要使溶液中二价铁离子与三价铁离子浓度相等,则根据质量守恒定律、得失电子守恒,反应的化学方程式:4Fe+10H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+5SO2↑+10H2O;
故答案为:4Fe+10H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+5SO2↑+10H2O.
点评 本题考查了浓硫酸的化学性质、氧化还原反应的计算、化学方程式的书写等知识,题目难度较大,试题涉及的知识点较大,题量较大,充分考查了学生对所学知识的掌握情况,注意明确浓硫酸的化学性质及浓硫酸与金属反应的原理.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:多选题
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒 | B. | HF可用于雕刻玻璃 | ||
| C. | NH3可用于制硝酸 | D. | SiO2可用于制太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
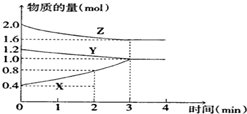 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少 | B. | 增大 | ||
| C. | 不变 | D. | 无法判断变化情况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com