
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
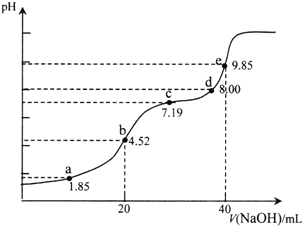
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
【答案】C
【解析】A.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,pH=1.85=pKa1,电离平衡常数表达式得到则c(H2SO3)=c(HSO3-),溶液体积大于20ml,a点所得溶液中:c(H2SO3)+c(SO32-)+c(HSO3-)=2c(H2SO3)+c(SO32-)<0.1molL-1 ,故A错误;B.b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),得到:c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B错误;C.c点pH=7.19=pKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=![]() =
=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3),故C正确;D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,Na2SO3水解显碱性,溶液中离子浓度c(OH-)> c(H+),故D错误;故选C。
,带入计算得到:c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3),故C正确;D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,Na2SO3水解显碱性,溶液中离子浓度c(OH-)> c(H+),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1) O2和O3是氧元素的两种单质。根据分子式回答。
等质量的O2和O3的物质的量之比为________,所含分子数之比为________,原子个数比为____________。
(2) NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46 g该气体,所含氮原子的物质的量为________,所含氧原子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子中,在溶液中能大量共存的是( )
A. CO32-、S2-、NO3-、Ca2+B. Al3+、Na+、S2-、SO42-
C. Al3+、NH4+、K+、SO42-D. Fe2+、Ca2+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中SO2常采用两种方法:液吸法和还原法。
Ⅰ.碱液吸收法
25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。第1步:用过量的浓氨水吸收SO2,并在空气中氧化;第2步:加入石灰水,发生反应Ca2++2OH-+2NH4+ +SO42-![]() CaSO4↓+2NH3·H2O K。
CaSO4↓+2NH3·H2O K。
(1)25 ℃时,0.1 mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)计算第2步中反应的K=___________。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)![]() S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
(3)表示液态硫(S)的燃烧热的热化学方程式为_____________。
(4)反应②中,正反应活化能E1____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[![]() =y]、温度T的关系如图所示。
=y]、温度T的关系如图所示。

比较平衡时CO的转化率α(CO):N____(填“>”“<”或“=”,下同)M。逆反应速率:N___P。
(6)某温度下,向10 L恒容密闭容器中充入2 mol H2、2 mol CO和2 mol SO2发生反应①、②,第5 min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为________。
②其他条件不变,在第7 min时缩小容器体积,α(SO2)______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。

下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),则N2H4完全燃烧反应的热化学方程式是___________________________________________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是______________________________。负极的电极反应式是_____________________________。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是___________________。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气__________L(假设空气中氧气体积含量为20%)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的说法正确的是
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 中和滴定实验中,锥形瓶用蒸馏水洗净须经烘箱烘干后才可使用
C. 配制0.5mol·L-1480mL的NaOH溶液需称量9.6 g NaOH固体
D. 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是粗盐提纯实验操作步骤,其名称为_____________(填“溶解”、“过滤”或“蒸发”),该步骤用到的玻璃仪器有:烧杯、玻璃棒和__________。实验结束后,取精盐配制成0.05L含NaCl 0.05mol 的食盐水,其浓度为___________________; 氯化钠中钠原子和氯原子之间形成的化学键属于__________(填“离子键”或“共价键”);实验室常用AgNO3来检验Cl-的存在,写出其离子方程式_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。______
(2)实验中他们取6.4g铜片和12mL 18mol·L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_______。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:__________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_____(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_____(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com