
【题目】有8种短周期元素,随着原子序数的递增(横坐标),其原子半径相对大小、最高正价或最低负价的变化情况如图所示。
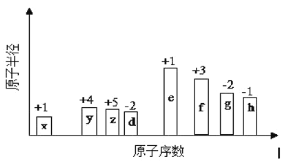
(1)元素h在周期表中的位置是____________。
(2)元素x和y形成的最简单化合物在家庭生活中的用途是____________。
(3)元素e、f最高价氧化物对应水化物的碱性强的是____________。(写化学式)
(4)元素z、x可形成原子个数比为1﹕3的化合物,其电子式为____________。
【答案】第三周期ⅦA族 燃料(或燃气、热源等符合题意的均可) NaOH ![]()
【解析】
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此分析。
(1) h是Cl元素,在周期表中的位置是第三周期ⅦA族;
(2)元素x和y形成的最简单化合物是甲烷,是天然气的主要成分,在家庭生活中的用途是燃料(或燃气、热源);
(3)元素e、f最高价氧化物对应水化物分别是氢氧化钠和氢氧化铝,钠和铝位于同一周期,钠的金属性强于铝,金属性越强,元素的最高价氧化物对应的水化物碱性越强,碱性强的是NaOH;
(4)元素z、x可形成原子个数比为1﹕3的化合物是氨气,其电子式为![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
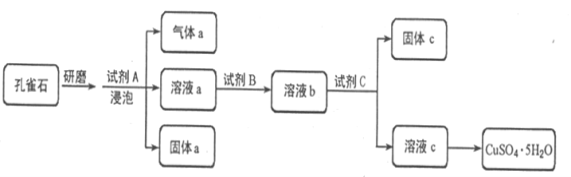
(1)研磨孔雀石的目的是________________________________________。
(2)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最宜选用_______(填字母)。
A 酸性KMnO4溶液 B 双氧水 C 浓硝酸 D 新制氯水
相应的离子方程式是______________。
(3)使用试剂C的目的是调节溶液的pH,使Fe3+转化为沉淀以便分离,试剂C宜选用__________(填字母)。A 稀硫酸 B NaOH溶液 C 氨水 D CuO
(4)常温下Fe(OH)3的Ksp = 4×10-38,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,将溶液的pH调节至4。则此时c(Fe3+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是
A.C6H12O6+6O2→6CO2+6H2O
B.CH2=CH2+HBr→CH3CH2Br
C.2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。实验中的下列结论正确的是( )

A. 自发反应一定是放热反应
B. 自发反应一定是吸热反应
C. 有的吸热反应也能自发进行
D. 吸热反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
A.①③B.②③C.②④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
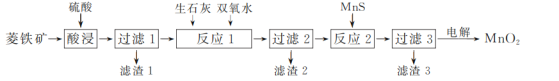
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
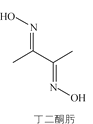
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
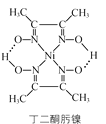
a.配位键 b. 离子键 c. 氢键 d. 范德华力
(4)某镍白铜的晶胞如图所示,其化学式为________。
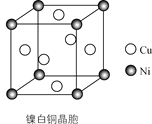
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com