
| 乙醇 |
| △ |
| 乙醇 |
| △ |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的
有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的| 4 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.
(1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.| 实验 序号 |
浓度时间 温度 (℃) |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50[ | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
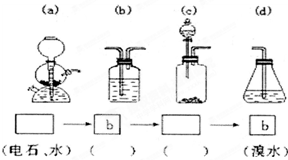 为探究乙炔与溴的加成反应,
为探究乙炔与溴的加成反应,查看答案和解析>>
科目:高中化学 来源: 题型:
 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO、KOH的结构式都可用X-Y-Z表示 |
B、O2-、Mg2+的结构中能量最高电子层的轨道表示式都可以用图表示: |
C、甲烷、四氯化碳的分子构型相似,均可以表示为: |
| D、分子式中n(C):n(H)=n:(2n+2)的物质不一定是烷烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com