
 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.分析 (1)该反应中Li元素化合价由0价变为+1价,V元素化合价由+5价变为+$\frac{10-x}{2}$价,放电时,Li是负极,电极反应式为xLi-xe-═xLi+,正极反应式为V2O5+xe-+xLi+═LixV2O5;
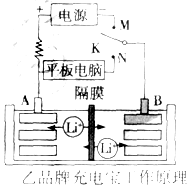
(2)当K与N相接时,该装置是原电池,B为负极,A为正极,负极上发生氧化反应,正极上发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动;
(3)当K与M相接时,该装置是电解池,A为阳极,阳极上失电子发生氧化反应,B为阴极,发生还原反应.
解答 解:(1)该反应中Li元素化合价由0价变为+1价,V元素化合价由+5价变为+$\frac{10-x}{2}$价,放电时,Li是负极,电极反应式为xLi-xe-═xLi+,正极反应式为V2O5+xe-+xLi+═LixV2O5,故答案为:V2O5+xe-+xLi+═LixV2O5;
(2)K与N相接时,B极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+,K与N相接时,A为正极,B为负极,Li+由B极区迁移到A极区,
故答案为:LixC6-xe-═xLi++C6; B;A;
(3)当K与M相接时,该装置是电解池,A为阳极,阳极上失电子发生氧化反应,电极反应式为:LiMnO2-xeˉ=Li1-xMnO2+xLi+,
故答案为:LiMnO2-xe-═Li1-xMnO2+xLi+.
点评 本题以新型电池为载体考查原电池和电解池原理,明确原电池和电解池电极上得失电子即可解答,注意原电池放电时,阴阳离子的移动方向,为易错点.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③④ | C. | ①② | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com