
 .
. .
.分析 (1)在元素周期表中,Cu、Ag、Au位于ⅠB族、各能级电子数相等价电子通式为(n-1)d10ns1,铜元素所在周期即为第四周期中,基态原子未成对电子数最多的原子为铬原子,据此答题;
(2)①CH3CHO中有碳氧双键,双键中有一个π键,根据碳原子周围的成键情况和孤电子对数可判断碳原子的杂化类型;
②分子形成氢键可以增大物质的熔沸点;
③在H、C、N、O中,第一电离能最大的元素为N,电负性最大的元素为O,根据价层电子对互斥理论,分子中孤电子对数越多,键角越小,据此答题;
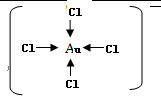
(3)[AuCl4]-中,每个氯离子与金离子之间都形成一个配位键,据此可画出结构式;
(4)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×$\frac{1}{2}$=3,金原子数为8×$\frac{1}{8}$=1,根据$ρ=\frac{m}{V}$进行计算;
(5)金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关,Cu+的核外电子排布为[Ar]3d10,没有未成对的电子,铜离子能与氨分子形成铜氨络合离子,所以Cu(OH)2易溶于浓氨水,据此答题;
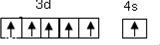
解答 解:(1)在元素周期表中,Cu、Ag、Au位于ⅠB族、各能级电子数相等价电子通式为(n-1)d10ns1,铜元素所在周期即为第四周期中,基态原子未成对电子数最多的原子为铬原子,其价层电子轨道示意图为 ,
,
故答案为:(n-1)d10ns1; ;
;
(2)①CH3CHO中有一个碳氧双键,双键中有一个π键,所以a个CH3CHO分子中π键的数目为a,根据碳原子周围的成键情况和孤电子对数可知,甲基中的碳的杂化方式为sp3,醛基中的碳原子的杂化方式为sp2,
故答案为:a;sp3、sp2;
②CH3CH2OH分子之间形成氢键,所以CH3CH2OH的沸点高于CH3CHO的沸点,
故答案为:CH3CH2OH分子之间形成氢键;
③在H、C、N、O中,第一电离能最大的元素为N,电负性最大的元素为O,它们组成的化合物的化学式为N2O、NO、N2O3、NO2、N2O4、N2O5,根据价层电子对互斥理论,分子中孤电子对数越多,键角越小,CH4、NH3、H2O分子中C、N、O的孤电子对数依次为0、1、2,所以CH4、NH3、H2O分子的键角依次减小,
故答案为:N2O、NO、N2O3、NO2、N2O4、N2O5;分子中孤电子对数越多,键角越小,CH4、NH3、H2O分子中C、N、O的孤电子对数依次为0、1、2;
(3)[AuCl4]-中,每个氯离子与金离子之间都形成一个配位键,所以有4个配位键,其结构式为 ,
,
故答案为:4; ;
;
(4)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×$\frac{1}{2}$=3,金原子数为8×$\frac{1}{8}$=1,根据$ρ=\frac{m}{V}$可知,晶胞的密度为$\frac{\frac{3×108+197}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{521}{{N}_{A}{a}^{3}}$g/cm3,
故答案为:$\frac{521}{{N}_{A}{a}^{3}}$;
(5)金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关,Cu+的核外电子排布为[Ar]3d10,没有未成对的电子,铜离子能与氨分子形成铜氨络合离子,所以Cu(OH)2易溶于浓氨水,反应的离子方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu+d能级上的未成对电子数为0;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
点评 本题考查较综合,涉及电子排布式、熔沸点的比较、氧化还原反应、晶胞的计算等知识点,根据密度公式、氧化还原反应原理等知识点来分析解答,难点是晶胞的计算,题目难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题

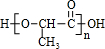 .
.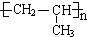 ,该反应类型是加聚反应.
,该反应类型是加聚反应.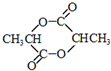 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
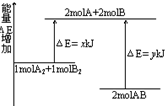
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
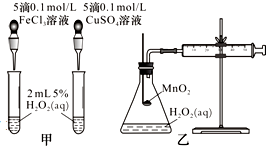 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: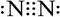 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2的熔点高于CH4 | 碳氧键键能大于碳氢键 |
| C | H2O的沸点高于H2S | H2O分子间形成了氢键 |
| D | 金刚石的硬度大于晶体硅 | 碳碳键键能大于硅硅键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素 Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素 X与 W形成的共价化合物有很多种 | |
| C. | 元素 W、X的氯化物中,各原子均满足 8 电子的稳定结构 | |
| D. | 元素 Z 可与元素 X 形成共价化合物 XZ2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com