
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量食盐 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
| n |
| V |
| m |
| MV |
| n |
| V |
| m |
| MV |


科目:高中化学 来源: 题型:
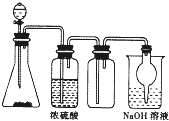 如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )
如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )| A、MnO2和浓盐酸制氯气 |
| B、锌粒和稀硫酸制氢气 |
| C、铜片和浓硝酸制二氧化氮 |
| D、浓氨水和生石灰制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
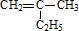 的键线式
的键线式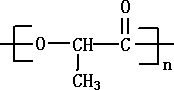 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为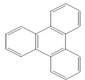 的一氯取代物有
的一氯取代物有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子中含氧官能团的名称是
分子中含氧官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com