
| A.吸热88kJ | B.吸热2.44 kJ | C.放热44kJ | D.吸热44 kJ |
科目:高中化学 来源:不详 题型:单选题
| A.Q1+Q2 > Q3 | B.2Q1+Q2 > 2Q3 | C.2Q1+Q2 < 2Q3 | D.2Q1+Q2=2Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a<b | B.a=b | C.a>b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:  CH4(g)+HC
CH4(g)+HC CH(g)+H2(g) △H1="156.6" kJ·mol-1
CH(g)+H2(g) △H1="156.6" kJ·mol-1 CH2(g)
CH2(g) CH4(g)+HC
CH4(g)+HC CH(g ) △H2="32.4" kJ·mol-1
CH(g ) △H2="32.4" kJ·mol-1 CH3CH
CH3CH CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
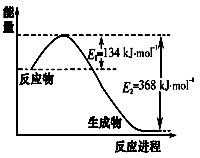
 2NH3(g) △H2=-92.4kJ/mol
2NH3(g) △H2=-92.4kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-1780kJ/mol | B.-1220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Q1+Q2>Q3 | B.Q1+Q2>2Q3 | C.2Q1+Q2<4Q3 | D.2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3中,每生成2mol NH3,
2NH3中,每生成2mol NH3,| A.放出92 kJ热量 | B.吸收92 kJ热量 |
| C.放出209kJ热量 | D.吸收209kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com