
 “长征”火箭发射使用的燃料是偏二甲肼 (C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼 (C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A. | 从a口通入四氧化二氮气体 | |
| B. | 从d口排除的是NO气体 | |
| C. | H+由A流向B | |
| D. | A极发生的电极反应式:C2H8N2-16e-+8H2O=CO2+N2+16H+ |
分析 由电子转移方向可知A为负极,偏二甲肼被氧化石花菜氮气和二氧化碳,电极方程式为C2H8N2-16e-+4H2O=2CO2+N2+16H+,B为正极,发生还原反应,四氧化二氮被还原生成氮气,电极方程式为N2O4+8e-+8H+=N2+4H2O,结合电极方程式解答该题.
解答 解:A.A为负极,则从a口通入偏二甲肼,故A错误;
B.由题给信息“产物又不污染空气(产物都是空气成分)”,可知从d口排除的是氮气,故B错误;
C.由电子转移方向可知A为负极,B为正极,所以H+由A流向B,故C正确;
D.偏二甲肼被氧化石花菜氮气和二氧化碳,电极方程式为C2H8N2-16e-+4H2O=2CO2+N2+16H+,故D错误.
故选C.
点评 本题考查化学电源新型电池,为高频考点,侧重于学生的分析能力的考查,本题难度不大,注意电极反应式的书写,以此判断各电极的变化.


科目:高中化学 来源: 题型:选择题
| A. | 将1〜2滴浓硫酸滴入紫色石蕊试液中,溶液先变红后变黑 | |
| B. | 浓硫酸因为具有吸水性,所以可以使蔗糖炭化 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性 | |
| D. | 浓硫酸和铜片在加热条件下反应时,浓硫酸既表现出酸性,又表现出强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向HCl和AlCl3的混合液中滴加NaOH溶液 | |
| B. |  向NaOH和Ca(OH)2的混合液中通入CO2 | |
| C. |  向NH4Al(SO4)2溶液中滴加 Ba(OH)2溶液 | |
| D. |  向NaOH和Na2CO3的混合液中滴加稀HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 微粒浓度关系:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
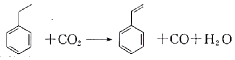
| A. | 分子中含有4个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾能力强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
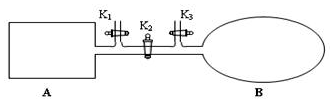 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com