
 2PbSO4��2H2O��������ͼװ�ý��е��(���Һ����)����õ� Ǧ������ת��0.4 mol����ʱ���缫����������11.2 g����ش� �������⡣
2PbSO4��2H2O��������ͼװ�ý��е��(���Һ����)����õ� Ǧ������ת��0.4 mol����ʱ���缫����������11.2 g����ش� �������⡣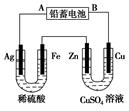



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ȼ�����ˮ�е��ܽ�ƽ�� | B������ȼ�ϵ���е缫�ϵķ�Ӧ |
| C�����ڳ�ʪ�Ŀ��������� | D������������������ý�����»��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����п����ͭ�����������ܽ���������� |
| B����������ZnSO4������뵽0.1mol/L��Na2S��Һ�У�Zn2+��Ũ�����ֻ�ܴﵽ1.6��10-23mol/L |
| C����ȥ��ҵ��ˮ�к��е�Cu2+���ɲ��ù���FeS��Ϊ������ |
| D���͵�FeS��Һ�м���FeSO4��Һ���Һ��c��Fe2+�����c��S2-����С����Ksp��FeS����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| A�������ĵ缫��ӦʽΪ��CO+O�����D2e��CO2 |
| B������ʱ�缫b��������O�����ɵ缫a����缫b |
| C������ʱ�����ɵ缫aͨ������������缫b |
| D����������ͨ���ĵ���Խ��β����CO�ĺ���Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������������� | B������������ԭ | C�������������� | D������������ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ʱ������ӦΪLi++e��=Li |
| B�����ʱ��������ϱ�ע�������ĵ缫Ӧ����ӵ�Դ�ĸ������� |
| C���ŵ�ʱ����ڲ�Li+���ƶ� |
| D���ŵ�ʱ������������Li+�õ��ӱ���ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.025 mol | B��0.050 mol | C��0.10 mol | D��0.20 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
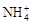 ��2e����Mn2O3��2NH3��H2O��
��2e����Mn2O3��2NH3��H2O��| A���ɵ����пͲΪ������ʯī��Ϊ���� |
| B���ɵ�ع���ʱ��������������пͲ�����·����ʯī�� |
| C���ɵ�س�ʱ������������״�������������ʴ�õ��� |
| D���ɵ�ؿ�ʵ�ֻ�ѧ������ܵ��ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A�����ˮ | B��п��ϡ���ᷴӦ |
| C����⺣ˮ | D���ֽ���Ȼ�� |
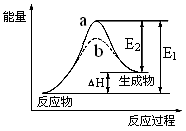
 CH3OH(g)����H ����90.8 kJ��mol��1
CH3OH(g)����H ����90.8 kJ��mol��1 CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1 CO2(g) + H2(g)����H����41.3 kJ��mol��1
CO2(g) + H2(g)����H����41.3 kJ��mol��1 CH3OCH3(g) + CO2 (g)�Ħ�H��
CH3OCH3(g) + CO2 (g)�Ħ�H�� 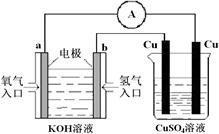
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com