
 .
.分析 (1)生成盐体现酸性,生成氯气体现还原性;
(2)由反应可知,生成1mol气体转移1mol电子;根据氯气和转移电子之间的关系式计算;
(3)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是2;
(4)2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O中I元素的化合价降低,S元素的化合价升高;
(5)若钝化表面生成致密的氧化膜,与硫酸铜不反应,反之不发生钝化,Fe与硫酸铜反应生成Cu.
解答 解:(1)该反应中,浓盐酸中的氯元素部分失去电子作还原剂,部分化合价不变,作酸,所以浓盐酸的性质是还原性和酸性,
故答案为:②;
(2)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以生成2mol氯气时其转移电子是2mol,故产生0.3molCl2,则转移的电子的物质的量为0.3mol,
故答案为:0.3;
(3)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是2, ,
,
故答案为: ;
;
(4)2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O中I元素的化合价降低,S元素的化合价升高,则S元素被氧化,NaIO3为氧化剂,1molNaIO3参加反应转移电子为1mol×(5-0)=5mol,
故答案为:S;NaIO3;5;
(5)将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面无现象,则发生了钝化;若铁棒表面有红色固体生成,则未发生反应,
故答案为:无现象;有红色固体生成.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化、转移电子的计算为解答的关键,侧重分析与计算能力的考查,注意元素化合价判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
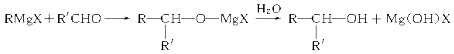
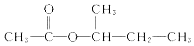 )的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
)的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.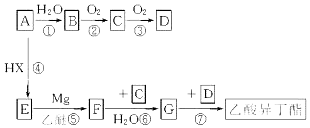
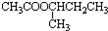 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ≡O$\stackrel{HCN}{→}$
≡O$\stackrel{HCN}{→}$ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
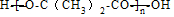 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数为2NA | |
| C. | 标准状况下,2.24L庚烷含有的分子数为0.1NA | |
| D. | 1 mol Na2O2中含有的阴离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带 正电 |
| B | 将铜粉加入 1.0mol•L-1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活 泼 |
| C | 用坩埚钳夹住用砂纸 仔细打磨过的铝箔在 酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比 较低 |
| D | 向盛有少量浓硝酸、 稀硝酸的两支试管中 分别加入一片大小相 同的铜片 | 浓硝酸中铜片很快开始溶解,并放出 红棕色气体;稀硝酸中过一会铜片表 面才出现无色气体,气体遇空气变红 棕色 | 浓硝酸氧化性强 于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0008mol/L | B. | 0.00125mol/L | C. | 0.8mol/L | D. | 1.25mo/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com