
| A. | 某无色溶液中可能含:SO42-、Br-、OH-、Ba2+ | |
| B. | 使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ba2+、HCO3- | |
| C. | 某溶液中,加铝粉有氢气放出,溶液中可能含:K+、Na+、H+、NO3- | |
| D. | 在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2-、CO32-、SO32- |
分析 A.钡离子与硫酸根离子反应生成硫酸钡沉淀;
B.使紫色石蕊试液变红色的溶液中存在大量氢离子,碳酸氢根离子与氢离子反应;
C.某溶液中加铝粉有氢气放出,该溶液为酸性或强碱性溶液,氢离子与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气;
D.c(H+)=10-14mol/L的溶液为碱性溶液,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.SO42-、Ba2+之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故A错误;
B.使紫色石蕊试液变红色的溶液为酸性溶液,溶液中存在大量氢离子,HCO3-与氢离子反应,在溶液中不能大量共存,故B错误;
C.加铝粉有氢气放出的溶液中存在大量氢离子或氢氧根离子,H+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,故C错误;
D.c(H+)=10-14mol/L的溶液中存在大量氢氧根离子,Na+、AlO2-、CO32-、SO32-之间不反应,都不与企业改革离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通锌锰干电池碳棒是负极,锌片是正极 | |
| B. | 盛水的铁器,在空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆、油脂 | |
| D. | 用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
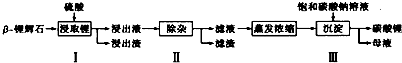
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离常数先增大后减小 | |
| B. | 当氨水和甲酸溶液体积相等时,c(HCOO-)=c(NH4+) | |
| C. | c(NH3•H2O)与c(NH4+)之和始终保持不变 | |
| D. | $\frac{c(N{{H}_{4}}^{+})c(HCO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)c(HCOOH)}$始终保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com