
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的剧烈程度为L<Q | |
| C. | R最高价氧化物对应水化物是强酸 | |
| D. | L2+与R2-的核外电子数相等 |
分析 短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
A.非金属性越强,气态氢化物越稳定;
B.金属性越强,与酸反应越剧烈;
C.R最高价氧化物对应水化物是硫酸,硫酸属于强酸;
D.核外电子数=质子数-离子带的电荷.
解答 解:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
A.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故A错误;
B.金属性Mg>Be,则Mg与酸反应越剧烈,故B错误;
C.R最高价氧化物对应水化物是硫酸,硫酸属于强酸,故C正确;
D.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,核外电子数不相等,故D错误.
故选C.
点评 本题考查结构性质位置关系应用,关键是根据原子半径及化合价来推断元素,注意对元素周期律的理解,熟悉元素及其单质、化合物的性质.


科目:高中化学 来源: 题型:选择题
| A. | 能导电的物质叫电解质 | |
| B. | NaCl晶体不导电,所以NaCl不是电解质 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | 电解质在通电时发生电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| B. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、NO${\;}_{3}^{-}$、Na+ | B. | H+、Br-、CO${\;}_{3}^{2-}$、K+ | ||
| C. | Fe2+、K+、OH-、SO${\;}_{4}^{2-}$ | D. | H+、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
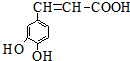
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按F、Cl、Br、I的顺序,卤素单质的熔沸点相应升高 | |
| B. | 烷烃随碳原子数目增加,熔沸点相应升高 | |
| C. | 冰的密度低于液态水的密度,冰会浮在水面上 | |
| D. | 按O、S、Se、Te的顺序,氧族元素的气态氢化物稳定性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com