
| A、第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴阳离子排列方式相同 |
| B、晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子 |
| C、离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键 |
D、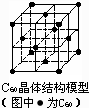 C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有12个 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H2和CO的混合气 |
| B、D2 |
| C、甲醇 |
| D、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )| A、元素Q的非金属性比R的强 |
| B、离子半径的大小顺序:r(Tm+)>r(Wn-) |
| C、元素Q的氧化物均为酸性氧化物 |
| D、元素T与元素R的最高正价之和等于8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1 L 0.2 mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA |
| C、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.2NA |
| D、1 mol Na2O2中含有的阴离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“钴酞菁”分子所形成的分散系具有丁达尔效应 |
| B、该物质属于有机高分子化合物 |
| C、此项工作的研究表明,人们可以改变分子的某些物理性质 |
| D、此项研究结果可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用丁达尔现象可以鉴别胶体和溶液 |
| B、在豆浆里加入盐卤做豆腐与胶体的聚沉有关 |
| C、胶体与溶液的分离可用渗析的方法 |
| D、KCl溶液、淀粉溶液和纯水都属于分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
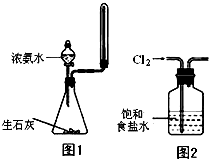 下列有关实验没有明显错误的是( )
下列有关实验没有明显错误的是( )| A、使用湿润过的pH试纸测量某溶液的pH |
| B、实验室可以用图1所示装置来制取少量氨气 |
| C、用量筒量取20 mL 0.50mol?L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.10mol?L-1H2SO4溶液 |
| D、实验室用图2所示装置除去Cl2中的少量HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com