
| A. | ①⑥⑦ | B. | ③⑦ | C. | ③⑤⑥ | D. | ③⑥⑦ |
分析 为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
解答 解:①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,反应速率加快,但铁的物质的量不变,所以生成氢气的物质的量不变;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量;
⑦升高温度(不考虑盐酸挥发)反应速率加快,但铁的物质的量不变,所以生成氢气的物质的量不变;
故选B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,本题不改变生成氢气总量的要求,答题时注意审题,难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
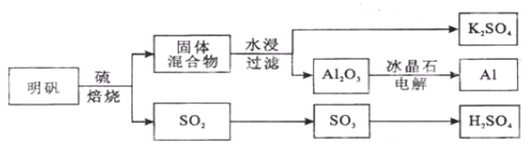
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此将胶体与溶液、悬浊液区分开来 | |
| C. | 光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 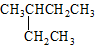 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 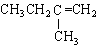 2-甲基丁烯 2-甲基丁烯 | D. |  苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-3-丁烯 | B. | 2,2-二甲基-1-丁烯 | ||
| C. | 3,3-二甲基-1-丁烯 | D. | 3,3-二甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 高纯度的硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| D. | 家庭用洁厕灵与“84 消内液”不能同时使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com