
【题目】下列分子和离子中中心原子VSEPR模型为四面体形,且分子或离子空间的构型为V形的是( )
A.NH4+
B.PH3
C.H3O+
D.OF2
【答案】D
【解析】解:A.NH4+离子中价层电子对=4+0=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该分子中含有一个孤电子对,所以其空间构型为三角锥型,故A错误; B.PH3分子中价层电子对=3+ ![]() =4,所以其VSEPR模型为正四面体,该分子中含有一个孤电子对,所以其空间构型为三角锥型,故B错误;
=4,所以其VSEPR模型为正四面体,该分子中含有一个孤电子对,所以其空间构型为三角锥型,故B错误;
C.H3O+离子中价层电子对=3+ ![]() =4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该离子中含有一个孤电子对,所以其空间构型为三角锥型,故C错误;
=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该离子中含有一个孤电子对,所以其空间构型为三角锥型,故C错误;
D.OF2分子中价层电子对=2+ ![]() =4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该分子中含有2个孤电子对,所以其空间构型为V形,故D正确.
=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该分子中含有2个孤电子对,所以其空间构型为V形,故D正确.
故选D.


科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是( )
A.体积相等、质量不等的CO和N2
B.等温等体积的O2和N2
C.等体积等密度的CO和N2
D.等压等体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下四种物质:①标况下11.2L CO2②1g H2③1.204×1024个N2④4℃时18mLH2O,下列说法不正确的是( )
A.分子个数:③>④>①=②
B.原子个数:③>④>①>②
C.体积:③>④>①=②
D.质量:③>①>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出.计算:
(1)原混合液中Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应前后溶液的密度均为1gcm﹣3 , 反应前后溶液体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现.下列有关说法中,正确的是( )
A.N5+离子中含有36个电子
B.O2与O4属于同位素
C.C60是有机物
D.H2与H3属于同种元素组成的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1 . Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
(1)W位于元素周期表第周期族,其基态原子的核外电子排布式为 .
(2)Y的气态氢化物的稳定性比Z的气态氢化物的稳定性(填“强”或“弱”).Y的第一电离能比Z的(填“大”或“小”).
(3)X的最常见的气态氢化物分子的VSEPR模型为 , 分子的空间构型是 .
(4)原子总数相同、价电子总数相同的分子或离子成为等电子体.分别写出一种与X02﹣互为等电子体的单质和化合物的化学式:、 . XO2﹣的中心原子采用杂化.
(5)[W(CN)6]3﹣离子中W的阳离子与CN﹣之间的共价键称为 , 该化学键能够形成的原因是 .
(6)图是R晶体的晶胞结构示意图,每个晶胞中含有个R原子. 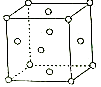
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需纯净的NaCl晶体,但现有的NaCL晶体中混有少量的Na2SO4和NH4HCO3 , 为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3+H2O+CO2 )
NH3+H2O+CO2 )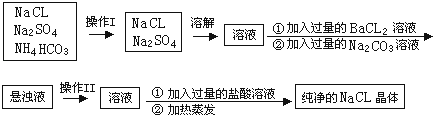
(1)上述操作I、II的名称分别为、 .
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCL2溶液已过量,其方法是 .
(3)操作“加入过量的Na2CO3溶液”的目的是 .
(4)操作“加入过量的盐酸溶液”的目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com