
| A. | 2L0.5mol/L亚硫酸钠溶液中含有的H+离子数为2NA | |
| B. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
分析 A、亚硫酸是弱酸,不能完全电离;
B、重水的摩尔质量为20g/mol;
C、氧元素的价态由-1价变为0价;
D、2molNO与1molO2反应后生成2molNO2,而NO2中存在平衡:2NO2?N2O4.
解答 解:A、亚硫酸是弱酸,不能完全电离,故溶液中的氢离子的个数小于2NA个,故A错误;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,则含9NA个质子,故B错误;
C、氧元素的价态由-1价变为0价,故生成0.1mol氧气转移0.2mol电子即0.2NA个,故C正确;
D、2molNO与1molO2反应后生成2molNO2,而NO2中存在平衡:2NO2?N2O4,故反应后分子个数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠溶液的PH 大于7 | |
| B. | 常温时,0.1mol/L乙酸溶液的PH约为3 | |
| C. | 乙酸能和碳酸钙反应放出CO2 | |
| D. | PH=1的醋酸溶液用水稀释1000倍后,pH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
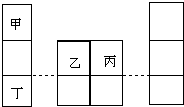 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )| A. | 简单离子半径:r(丁)>r(乙)>r(丙) | |
| B. | 元素丙的简单气态氢化物的热稳定性比乙的强 | |
| C. | 仅由甲、乙、丙三种元素形成的化合物的水溶液一定呈酸性 | |
| D. | 丙和丁形成的两种化合物中阴阳离子个数比不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法制铝工艺的发明使铝在生产生活中得以迅速普及 | |
| B. | 合成氨工艺的开发缓解了人类有限耕地资源与庞大粮食需求的矛盾 | |
| C. | 研究影响化学反应速率的因素对提高可逆反应的限度具有决定性作用 | |
| D. | 燃料电池的能量转换效率高具有广阔的前景 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低反应体系的压强 | B. | 增加反应物碳的用量 | ||
| C. | 缩小反应体系的体积 | D. | 减少体系中CO的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧只生成白色的氧化钠固体 | |
| B. | 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧 | |
| C. | 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作 | |
| D. | 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com