
| A. | 既不是电解质也不是非电解质 | |
| B. | 甲烷燃烧的产物可导致酸雨 | |
| C. | 甲烷可以做燃料电池的燃料 | |
| D. | 等质量的不同烷烃充全燃烧,甲烷的耗氧最最少 |
分析 A.电解质是指溶于水溶液中或在熔融状态下就能够导电;在水溶液和熔融状态下都不导电的化合物为非电解质;
B.依据酸雨的成因解答;
C.甲烷能够燃烧生成二氧化碳和水;
D.等质量的烷烃完全燃烧耗氧量取决于$\frac{y}{x}$,$\frac{y}{x}$越大耗氧量越多;
解答 解:A.甲烷为化合物,在水溶液和熔融状态下都不导电,是非电解质,故A错误;
B.酸雨成因是硫的氧化物、氮的氧化物的排放,甲烷燃烧生成二氧化碳,不会引起酸雨,故B错误;
C.甲烷、氧气在酸性或者碱性介质中可以形成燃料电池,通甲烷的一极为负极,故C正确;
D.等质量的烷烃完全燃烧耗氧量取决于$\frac{y}{x}$,所以烃中,甲烷中$\frac{y}{x}$最大,所以甲烷耗氧量最大,故D错误;
故选:C.
点评 本题考查了甲烷的性质,熟悉甲烷的结构及性质是解题关键,注意同质量、同物质的量烃耗氧量规律,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 56g Fe与稀HNO3完全反应时一定转移3NA个电子 | |
| B. | 标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5NA | |
| C. | 常温常压下,0.1NA个Al与足量氢氧化钠溶液反应生成3.36 LH2 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
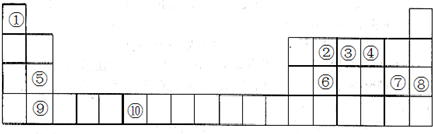
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②③⑤⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
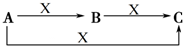 A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:
A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I- 可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50 mL该溶液与过量Zn充分反应,生成0.56 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
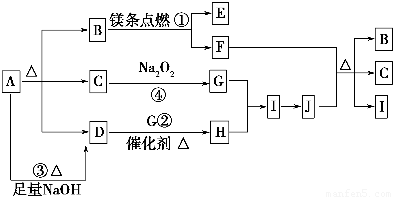
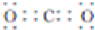 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中水电离出的c(H+)=10-8mol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(C1-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
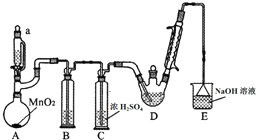 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com