
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法不正确的是( )
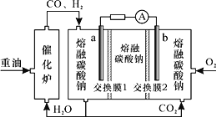
A.b为电池的正极
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经交换膜2移向b极
D.H2参与的电极反应为:H2-2e-+CO32-=H2O+CO2
科目:高中化学 来源: 题型:
【题目】请写出电子式
(1)原子的电子式
H____ 、Ca ____、N____、 O____、 Cl____ 、C____ 、 Al____
(2)离子的电子式
①简单阳离子:氢离子____ 钾离子____ 钙离子____
②简单阴离子:氯离子____ 氧离子____
③复杂阴、阳离子:铵根离子____ 氢氧根离子____ 过氧根离子(![]() )____
)____
(3)离子化合物的电子式
NaCl____ CaO____ CaCl2_____ CaF2 ____ Na2O ____ Na2O2____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为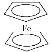 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法错误的是( )
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法错误的是( )
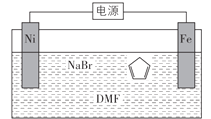
A.制备二茂铁总反应为:Fe+2![]() =
=![]() +H2↑
+H2↑
B.电解制备需要在无水条件下进行
C.Ni电极与电源负极连接
D.阳极电极反应为:2Br--2e-=Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
B.已知2SO2(g)+O2(g) 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
C.由C(s)+![]() O2(g)=CO(g)ΔH=+110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1
O2(g)=CO(g)ΔH=+110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向n点的溶液中加入少量CdCl2固体,溶液组成由n沿npm线向m方向移动
D.温度升高时,p点的饱和溶液的组成由p沿pq线向q方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从绿色化学、环保的角度选择制取硫酸铜的原料________。
a.Cu b.CuO
c.CuS d.Cu(OH)2·CuSO4
(2)写出从硫酸铜溶液中得到硫酸铜晶体的操作:________、________、过滤、洗涤……
(3)如图球形管装置的作用:_________________________________________。
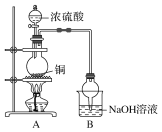
(4)反应后溶液中存在Cu2+,但浓硫酸有吸水性,不能通过溶液颜色来判断Cu2+的存在,请写出一种简便的方法验证Cu2+的存在:_________________________________________________________________。
(5)在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体。
已知:2CuS![]() Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
(6)根据以上信息,说明Cu与浓硫酸反应需要控制哪些因素:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH![]() 、—CH3、CH
、—CH3、CH![]() 都是重要的有机反应中间体,有关它们的说法正确的是( )
都是重要的有机反应中间体,有关它们的说法正确的是( )
A. 它们互为等电子体,碳原子均采取sp2杂化
B. CH![]() 与NH3、H3O+互为等电子体,立体构型均为正四面体形
与NH3、H3O+互为等电子体,立体构型均为正四面体形
C. CH![]() 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D. CH![]() 与OH-形成的化合物中含有离子键
与OH-形成的化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com