
下列各组中,两种气体的分子数一定相等的是( )
A. 温度相同,体积相同的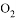 和
和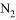 B. 温度相等,压强相等的
B. 温度相等,压强相等的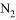 和
和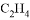
C. 压强相同,质量相同的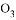 和
和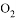 D. 体积相同,密度相等的
D. 体积相同,密度相等的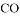 和
和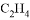
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是
A. 残余固体是铜和铁
B. 最后得到的溶液中一定含有Cu2+
C. 将残余固体加入到稀H2SO4中,有气泡产生
D. 最后得到的溶液中可能含有Fe3+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
在下列各溶液中逐渐通入CO2气体直至过量,会出现沉淀先产生后消失现象的是
①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液 ⑥NaAlO2溶液
A. 全部 B. 只有③⑥ C. 除①⑤⑥ D. 只有②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
(1)从氧化还原的角度分析水在下列化学反应中只做还原剂的是_______________
A电解水 B钠和水的反应(2Na+2H2O===2NaOH+H2↑)
C氟气和水反应(2F2+2H2O===4HF+O2) D氯气和水反应(Cl2+H2O===HCl+HClO):
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是________;若反应方程式中转移了0.4 mol电子,则氧化产物的质量是_____ g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,这个事实说明Fe2+、Cl-、Br—三种粒子还原性由强到弱的排列顺序为:__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列推断正确的是( )
A. 铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C. 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D. 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属均作还原剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
用自来水养金鱼时,将水注入鱼缸以前需把水放在阳光下暴晒一段时间,目的是( )
A. 起到杀菌作用 B. 使水中次氯酸分解
C. 提高水的温度 D. 增加水中氧气的含量
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
A. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
B. 参加反应的金属的总质量 3.6g<m<9.6 g
C. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100mL
D. 当金属全部溶解时收集到NO气体的体积在标况下为 2.24L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)?C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
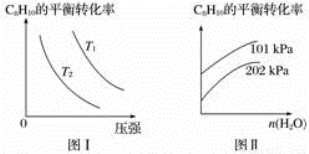
①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:简答题
镁及其化合物有广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下
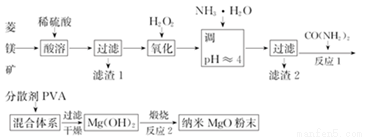
回答下列问题:
(1)滤渣1为____________(填化学式),CO(NH2)2的电子式为______。
(2)在实验室煅烧滤渣2制得的金属氧化物为______(填化学式),需要的仪器除酒精灯、三脚架以外,还需要______(填名称)。
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为__________。
(4)室温时,加入CO(NH2)2,产生沉淀。当 Mg2+沉淀完全时,溶液中的c(OH-)=_______(离子浓度小于1.0×10-5 mol•L-1时,即可认为该离子沉淀完全;室温时,Ksp[Mg(OH)2]=1.96×10-11)
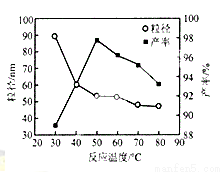
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制务纳米MgO。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com