
【题目】下列有关说法错误的是
A.油脂的种类很多,但它们水解后都一定有一产物相同
B.淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体
C.甲苯与氯气在光照下反应主要生成2,![]() 二氯甲苯
二氯甲苯
D.只用新制的![]() 悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液
悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液
科目:高中化学 来源: 题型:
【题目】根皮素R( )可应用于面膜、护肤膏霜和精华素中。其中一种合成R的路线如下:
)可应用于面膜、护肤膏霜和精华素中。其中一种合成R的路线如下:

已知
①
②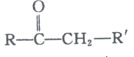 +R’’CHO
+R’’CHO +H2O
+H2O
(1)A的化学名称是___________,B→C的反应类型是___________。
(2)D的结构简式是___________,其核磁共振氢谱共有___________组峰。
(3)E→F的化学方程式为___________,G的官能团的名称是___________。
(4)G→H的化学方程式为______________________。
(5)M是F的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①1能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
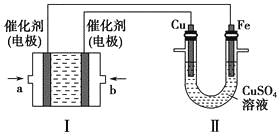
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是
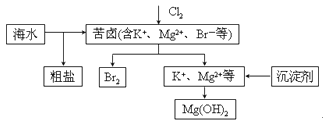
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:
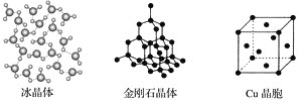
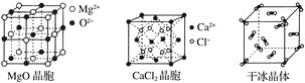
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可充电的碘化物水性液流电池以锌和惰性材料为两极材料,放电时的工作原理为Zn+I2Br-=Zn2++2I-+Br-,如图所示,下列说法正确的是( )

A.a极材料为锌
B.放电时,正极的电极方程式I2Br--2e-=Zn2++2I-+Br-
C.充电时,左电极室Br-因发生氧化反应而减少
D.充放电过程中,右电极室粒子浓度没有变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )
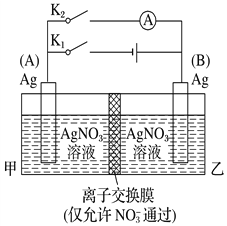
A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ΔH大于0表示吸热反应;ΔH小于0表示放热反应。关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O![]() Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)
Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)![]() NaUr(s)下列对反应②的叙述中正确的是( )
NaUr(s)下列对反应②的叙述中正确的是( )
A. 反应的ΔH>0 B. 降低温度,平衡向逆反应方向移动
C. 反应的ΔH<0 D. 升高温度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:________________;某学习小组为了测定电解后所得溶液NaOH的浓度,设计了如下实验操作步骤:
①取电解后的溶液10.00mL,加水稀释至100mL;
②量取20.00mL于洁净的锥形瓶,滴加2~3滴酚酞试剂;
③用浓度为0.1010mo/L的标准HCl滴定至终点并记录滴定管的读数为25.00mL
请回答有关问题
①步骤①可能用到的仪器除移液管外,还有_______________
②滴定终点的现象是____________,此溶液中c(Na+)______c(Cl-)(填“<”、“>”或“=”)
③下列操作可能导致所得浓度偏大的是______________
a. 锥形瓶用待测溶液润洗 b.碱式滴定管用待测液润洗
c. 滴定管滴定前有气泡,滴定后无气泡 d. 滴定终点俯视读数
④该实验设计存在的明显不足的是____________
(2)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
①室温下,0.1 mol·L–1 NaClO溶液的pH_____ 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:_____
(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
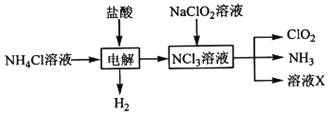
电解时发生反应的化学方程式为_______________________,溶液X的溶质主要是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com