
【题目】用NA 表示阿伏加德罗常数,则下列说法中正确的是
A.2克H2所含的原子数目为NA
B.2molO3和3molO2所含的氧原子数都是6NA
C.常温常压下,11.2L氧气含原子数为NA个
D.2.3g金属钠含有的电子数为NA
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
(装置分析)
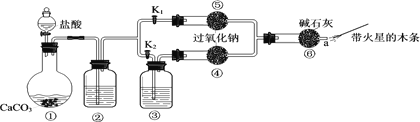
(1)装置①中反应的离子方程式是______。
(2)装置②中的试剂是______(填序号)。
a.饱和Na2CO3溶液 b.饱和NaHCO3溶液 c.浓H2SO4
(3)装置③中的试剂是______。
(进行实验)步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。 步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是______。
(5)过氧化钠跟二氧化碳反应的化学方程式是______。
(实验反思)
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是______。
(7)需要补充的实验操作是:取⑤中反应后的少量固体,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_________。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第三电离能I3(Fe)____I3(Mn)(填“大于”或“小于”),原因___。
(3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____熔点高,其主要原因是_______。
(4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是_______。
(5)液态环戊二烯中存在的微粒间相互作用有____
A 范德华力 B 氢键 C ![]() 键 D π键
键 D π键
环戊二烯分子中碳原子的杂化轨道类型是_____
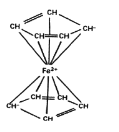
配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是____。
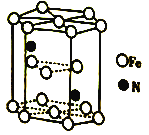
(6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业纯碱中常含有NaCl、Na2SO4等杂质。研究小组设计了如下实验装置,通过纯碱与酸反应生成的m(CO2),测定质量为m g某工业纯碱的纯度,下列叙述正确的是
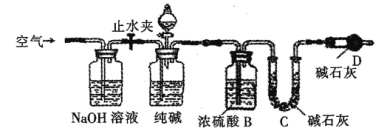
A.通过称量反应前后装置B的质量,获取m(CO2)
B.通过称量反应前后装置C的质量,获取m(CO2)
C.通过称量反应前后装置C和D的质量,获取m(CO2)
D.通过称量反应前后装置D的质量,获取m(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工农业发展,NH4Cl的价格低迷、需求降低导致利用“侯氏制碱法”生产的碱厂出现亏损。“新联合制碱法”应运而生,流程如下:
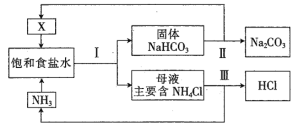
(1)写出气体X的结构式_______________________。
(2)上述工艺流程中参与循环使用的气体有____________、____________。
(3)所得产品Na2CO3中不会含有NH4Cl,原因是__________________(用化学方程式表示)。
(4)过程III以MgO为催化剂进行转化,示意图如下:
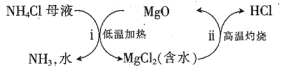
①步骤ii实际上要经过加热和高温两步反应,“加热”步骤制得HCl,“高温”步骤得到MgO,其化学方程式分别为__________________、________。
②过程III分两步得到NH3和HCl,比一步得到NH3和HCl的好处是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强B. 混合气体的密度
C. 3v逆(C)=2v正(B)D. 气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.向氯化铝溶液中加入过量氨水: Al3+ + 4OH-=AlO2-+ 2H2O
C.碳酸氢铵溶液中加足量的氢氧化钠溶液:NH4+ + OH- = NH3↑ + H2O
D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、Ca(OH)2溶液、BaCl2溶液、Ba(NO3)2溶液
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为________(只填化学式)。
(2)操作Ⅲ的名称是________,所需用到的仪器主要有铁架台、酒精灯、铁圈、玻璃棒__________(填仪器名称)。
(3)加盐酸的目的是(用离子方程式表示)_________________________
Ⅱ.一份无色溶液中可能含有Na+、Fe3+、H+、Mg2+、CO32-、OH-、HCO3-、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①向溶液中滴加酚酞试液,溶液显红色:
②取2mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(4)原溶液中一定存在的离子是______________,一定不能大量存在的离子是_______________。
(5)经过上述操作后,还不能肯定是否存在的离子是________。对可能含有的离子,如何进行实验以进一步检验____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com