
【题目】 利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A.2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
B.Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如表所示。下列说法中,正确的是( )
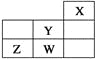
A. W的最高价氧化物对应的水化物是强酸
B. Y的原子半径在同周期主族元素中最大
C. 还原性:W->Z2-
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为
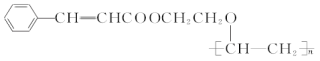 。按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到。
。按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到。
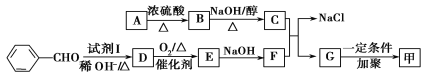
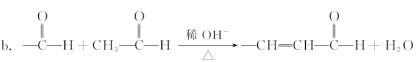
已知:
a.—CH2OH + —CH2OH![]() —CH2OCH2— + H2O
—CH2OCH2— + H2O
请回答下列问题:
(1)质谱图显示A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积之比为2∶2∶1,则A的结构简式为_______________________________________。
(2)试剂I的名称是__________________;B→C的反应类型是__________________。
(3)写出下列反应的化学方程式:
①D→E___________________________________________________________________;
②C+F→G+NaCl_________________________________________________________。
(4)E的一种同分异构体的水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
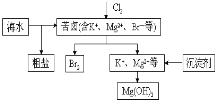
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是( )
A. 该化合物仅含碳、氢两种元素
B. 该化合物中碳、氢原子个数比为1:2
C. 无法确定该化合物是否含有氧元素
D. 该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为: Fe2O3(s)+3CH4(g) ![]() 2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g)
(1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为______________;
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______________;
A.CH4的转化率等于 CO的产率
B.混合气体的平均相对分子质量不变
C.v 正(CO): v 逆(H2)=1 : 2
D.固体的总质量不变
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g) ![]() Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5
若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=______________。
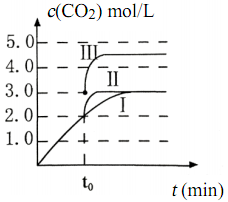
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件, 曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________L。
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件, 曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
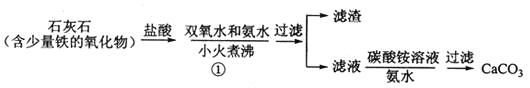
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
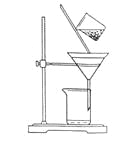
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com