
|
18.6 g NaOH和Na2CO3的固体混合物投入200 ml 2.0 mol·L-1的盐酸中恰好完全反应,不再产生气泡,则所得溶液中溶质的质量为 | |
| [ ] | |
A. |
25.8 g |
B. |
11.7 g |
C. |
23.4 g |
D. |
无法计算 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:黑龙江省哈师大附中2011-2012学年高一4月月考化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)的CaO.
(1)Ca元素在周期表中位置是________,其原子结构示意图________.
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为________,比A与Si形成的化合物为E.D的沸点比E的沸点________(填“高”或“低”).
(3)配平化学方程式:________P+________FeO+________CaO-________Ca3(PO4)2+________Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为________(填名称);检测Mn+的方法是________(用离子方程式表达).
(5)取1.6 g钙线试样,与水充分反应,生成448 mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g.
查看答案和解析>>
科目:高中化学 来源:江苏省射阳中学2011-2012学年高二下学期期末考试化学试题 题型:022
合成氨的发明是本世纪科学领域中最辉煌的成就之一.以下是与NH3相关的工业过程示意图.
已知:CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890 kJ/mol
CO2(g)+2H2O(g) ΔH=-890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.0 kJ/mol
2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-571.6 kJ/mol
2H2O(g) ΔH=-571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g)和H2(g)的热化学反应方程式:________.
(2)生产中涉及H2和CO2的分离.你认为可取的方法是(填代号)________.
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为:________.
(4)合成尿素的反应分两步进行:
①CO2(g)+2NH3(g)![]() H2NCOONH4(aq) ΔH=-159.47 kJ/mol(氨基甲酸铵)
H2NCOONH4(aq) ΔH=-159.47 kJ/mol(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+H2O(l) ΔH=+28.49 kJ/mol在生产条件下,单位时间内获得尿素的产量与压强和n(NH3)∶n(CO2)的关系如下图所示.生产过程中n(NH3)∶n(CO2)的最佳配比为________,而实际生产往往使n(NH3)∶n(CO2)≥3,这是因为________.
CO(NH2)2(aq)+H2O(l) ΔH=+28.49 kJ/mol在生产条件下,单位时间内获得尿素的产量与压强和n(NH3)∶n(CO2)的关系如下图所示.生产过程中n(NH3)∶n(CO2)的最佳配比为________,而实际生产往往使n(NH3)∶n(CO2)≥3,这是因为________.
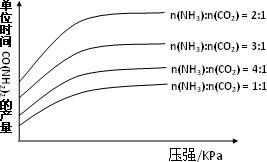
在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是________.
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3.若HNO3与NH3的反应是完全的,有标准状况下78.4 L NH3经上述反应过程生成120 g NH4NO3.则NH3转化为HNO3的转化率为________.
查看答案和解析>>
科目:高中化学 来源:福建省四地六校2012届高三期中联考试题化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca.
(1)Ca的原子结构示意图________.
(2)配平用钙线氧脱鳞的化学方程式:
________P+________FeO+________CaO![]() ________Ca3(PO4)2+________Fe
________Ca3(PO4)2+________Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为________,检测Mn+的方法是________(用离子方程式表达).
(4)取1.6 g钙线试样,与水充分反应,生成224 ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g.
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S.
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-2
S(s)+O2(g)=YO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________.
查看答案和解析>>
科目:高中化学 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca.
(1)Ca的原子结构示意图________.
(2)配平用钙线氧脱磷的化学方程式:
________P+________FeO+________CaO![]() ________Ca3(PO4)2+________Fe
________Ca3(PO4)2+________Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为________,检测Mn+的方法是________(用离子方程式表达).
(4)取1.6 g钙线试样,与水充分反应,生成224 ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g.
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S.
已知:CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=YO2(g);ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的发明是本世纪科学领域中最辉煌的成就之一。以下是与NH3相关的工业过程示意图。

已知:CH4(g) + 2O2(g) ==CO2(g)+2H2O(g)
△H = — 890kJ/mol
2CO(g) + O2(g) == 2CO2(g)
△H = — 566.0 kJ/mol
2H2(g) + O2(g) ==2H2O(g)
△H = — 571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g) 和H2(g)的热化学反应方程式:
_ 。
(2)生产中涉及H2和CO2的分离。你认为可取
的方法是(填代号) 。
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为: 。
(4)合成尿素的反应分两步进行:
①CO2(g)+ 2NH3(g)![]() H2NCOONH4(aq)△H = — 159.47kJ/mol
H2NCOONH4(aq)△H = — 159.47kJ/mol
(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
 在生产条件下,单位时间内获得尿素的产
在生产条件下,单位时间内获得尿素的产
量与压强和n(NH3):n(CO2)的关系如右图
所示。生产过程中n(NH3):n(CO2)的最佳
配比为 ,而实际生产往往使
n(NH3):n(CO2)≥3,这是因为
_ 。
在得到的尿素溶液中会含有少量的氨
基甲酸铵,除去这种杂质最简便的方法是 。
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3。若HNO3与NH3的反应是完全的,有标准状况下78.4LNH3经上述反应过程生成120g NH4NO3。则NH3转化为HNO3的转化率为 _ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com