
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
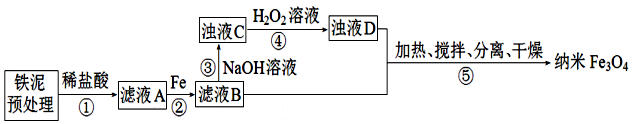
分析 铁泥(主要成分为Fe2O3、FeO和少量Fe)与稀盐酸反应得到的滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液B的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,据此分析解答.
解答 解:(1)搅拌、适当升高温度可提高铁泥与盐酸的反应速率;
故答案为:搅拌;适当升高温度;
(2)滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子和反应过量的盐酸:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(3)由表可知Fe(OH)3完全沉淀的pH为3.0,即c(H+)=1×10-3mol/L,则c(OH-)=1×1011mol/L,该温度下Ksp[Fe(OH)3]=c(Fe3+)•c(OH-)3=1×10-5•(1×10-11)3=1.0×10-38;
故答案为:1.0×10-38;
(4)步骤④中,浊液D中的氢氧化亚铁与过氧化氢反应生成FeOOH,反应为:2Fe(OH)2+H2O2=2FeOOH+2H2O;步骤④中,防止其在步骤⑤中继续氧化+2价铁元素,反应完成后需再加热一段时间除去剩余H2O2;
故答案为:2Fe(OH)2+H2O2=2FeOOH+2H2O;加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素;
(5)⑤为FeOOH与氯化亚铁加热搅拌发生反应生成产品Fe3O4,反应为:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4;
故答案为:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O; 过滤;洗涤;
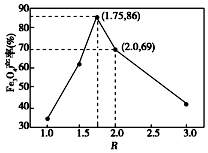
(6)浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b,则滤液B中与FeOOH反应的亚铁离子物质的量为b-a,由图可知R(R=$\frac{n(\stackrel{+3}{Fe})}{n(\stackrel{+2}{Fe})}$)=1.75时,Fe3O4的产率最高,则$\frac{a}{b-a}$=1.75,解得:$\frac{a}{b}$=0.636;
故答案为:0.636.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Na2CO3 | C. | SiO2 | D. | CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧乙酸(
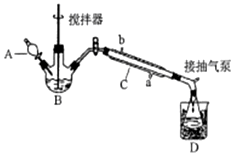
过氧乙酸( 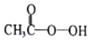 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
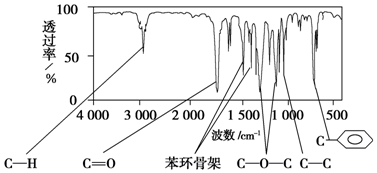
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
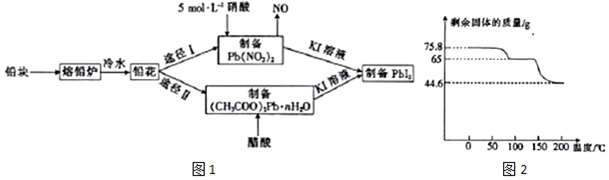
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
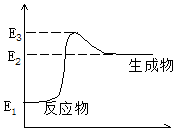 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )| A. | 减小压强时,Q的值增大 | B. | 升高温度时,Q的值减小 | ||
| C. | 该反应是吸热反应 | D. | Q=E3-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com