
Na2CO3溶液中滴入酚酞呈红色,原因是(用离子方程式表示) 。加热后颜色变________(深或浅),原因是 。
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O===2Fe2++SO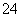 +4H+
+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2===4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2HCO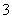 +Ca2++2OH-===CaCO3↓+2H2O+CO
+Ca2++2OH-===CaCO3↓+2H2O+CO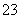
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO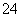 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO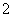 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实不能证明醋酸是弱电解质的是( )
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.在相同条件下,醋酸溶液的导电性比盐酸的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
判断以下几种叙述中不正确的是( )
A.某温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数
B.醋酸钠和醋酸的混合液中若c(Na+)=c(CH3COO-),则溶液中c(H+)=c(OH-)
C.如果定义pOH=-lgc(OH-),则常温下某水溶液中的pOH和pH之和等于14
D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,各组离子可能大量共存的是 ( )
A.pH=7的溶液中:K+、Fe3+、Cl-、NO3—
B.强酸性溶液中:Cu2+、ClO-、Cl-、Ba2+
C.0.1 mol·L-1 的NaHCO3溶液中:K+、Al3+、Fe3+、NO3—
D.由水电离出的c(H+)=10-13 mol·L-1的溶液中:Al3+、K+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-,HB-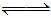 H++B2-。
H++B2-。
回答下列问题:
(1)Na2B溶液显 (填“酸性”、“中性”或“碱性”),理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1 Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1 B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”、“>”或“=”),理由是
。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
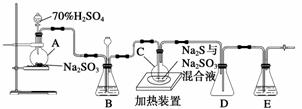
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq)(Ⅰ)2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)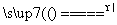 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若__________________________________________________,则整个装置气密性良好。装置D的作用是________________________________________________________________________。
装置E中为______________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是______________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:___________________________________________________
________________________________________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O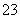 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为( )
A.1.5 mol·L-1 B.1 mol·L-1
C.2.5 mol·L-1 D.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com