
| A、Na和O2 |
| B、Fe和FeCl3 |
| C、CO2和NaOH |
| D、AlCl3和NaOH |


科目:高中化学 来源: 题型:
| A、漂白粉的有效成分是Ca(ClO)2和CaCl2 |
| B、为消除碘缺乏病,我国政府规定在生产食用盐时必须加入一定量的单质碘 |
| C、向豆浆中加入盐卤可以做豆腐 |
| D、SO2的大量排放带来的环境问题是光化学烟雾和酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图进行实验,试管中现象对应的离子方程式不正确的是( )
如图进行实验,试管中现象对应的离子方程式不正确的是( )| 选项 | a | b | 试管中现象 | 离子方程式 |
| A | 硫酸 | KI淀粉 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 稀盐酸 | Na2CO3 | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3-; HCO3-+H+=H2O+CO2↑ |
| C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++SiO32-=H2SiO3(胶体) |
| D | 硫酸 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-= BaSO4↓+H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④⑤ |
| C、①②⑤ | D、③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(0H-) |
| B、O.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
| C、pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、浓度均为0.1 mol/L的①NH4Cl②NH4Al(SO4)2③NH4HCO3三种溶液,其中c(NH4+):③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
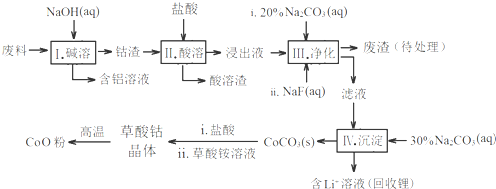
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com