
分析 5mL的混合气体通过足量的浓H2SO4,体积减少至4mL,说明一定存在氨气,则一定不存在与氨气反应的氯化氢气体;再通过足量的NaOH溶液,体积减小到2mL,由于不存在氯化氢,则一定存在二氧化碳气体;余下的气体接触空气后立即变色,说明一定含有NO,则一定不存在与一氧化氮反应的氧气,据此进行解答.
解答 解:将5mL的混合气体通过足量的浓H2SO4,体积减少至4mL,说明一定存在1mLNH3,则一定不存在与NH3反应的HCl气体;再通过足量的NaOH溶液,体积减小到2mL,由于不存在HCl,则一定存在SO2气体,体积为2mL;剩余气体接触空气后立即变色,遇到空气变色的气体为NO,则一定含有NO;由于一氧化氮与氧气反应,二者不能共存,所以一定不存在O2,
根据以上分析可知,原混合气体中一定含有的气体为:NH3、SO2、NO,同温同压下气体的体积之比为:1mL:2mL:2mL=1:2:2;由于NH3会与HCl反应生成白色固体NH4Cl,所以有NH3就一定不含HCl;NO遇O2会变色,而混合气体无色,所以有NO就一定无O2,混合气体中一定不存在的气体为HCl、O2.
(1)原混合气体中一定含有的气体为NH3、SO2、NO,故答案为:NH3、SO2、NO;
(2)原混合气体中一定含有的气体为NH3、SO2、NO,同温同压下气体的体积之比为1mL:2mL:2mL=1:2:2,故答案为:1:2:2;
(3)混合气体中一定不存在的气体为HCl、O2,因为HCl气体不能与NH3共存,O2气体不能与NO共存,故答案为:HCl、O2;HCl气体不能与NH3共存,O2气体不能与NO共存.
点评 本题考查了常见气体的检验,题目难度中等,注意掌握常见气体的物理性质、化学性质及检验方法,明确常见的有色气体,如遇到空气变色的气体为NO,二氧化氮为红棕色气体,氯气为黄绿色氯气等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲醇 | B. | 乙醇 | C. | 乙二醇 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
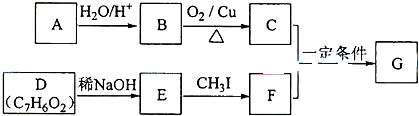
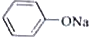 +RCH2I→
+RCH2I→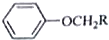
 .
. .
. (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能说明盐酸是强酸:2HCl+CaCO3═CaCl2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
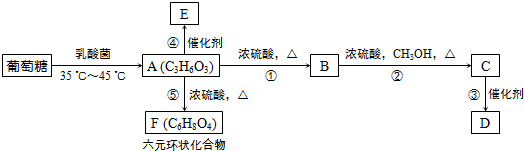
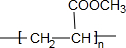 ,⑤2
,⑤2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$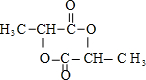 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属(除铯外),密度都小于水 | |
| B. | 单质的熔、沸点随原子序数的增加而升高 | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 氧化能力最强的是铯原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com