
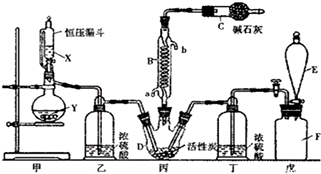
分析 由(4)戊是贮氯气装置,可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
(1)SO2Cl2遇水能发生剧烈的水解反应,产物之一为氯化氢气体,另外生成物质为硫酸,可知硫元素化合价;
(2)由仪器结构特征可知,仪器E为分液漏斗;SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,说明SO2与氯气之间的反应属于放热反应;
(3)甲装置制备二氧化硫,Cu与浓硫酸反应需要加热,稀硝酸与硫酸钠不反应;
(4)E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水;潮湿的氯气和二氧化硫反应生成HCl与硫酸;
(5)分离沸点不同的液体可以用蒸馏的方法;计算氯气物质的量,再计算磺酰氯的理论产量,进而计算其产率.
解答 解:由(4)戊是贮氯气装置,可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
(1)SO2Cl2遇水能发生剧烈的水解反应,产物之一为氯化氢气体,另外生成物质为硫酸,可知硫元素化合价+6价,故答案为:+6;
(2)由仪器结构特征可知,仪器E为分液漏斗;SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,说明SO2与氯气之间的反应属于放热反应,仪器C的作用是:吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解,
故答案为:分液漏斗;放;吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解;
(3)甲装置制备二氧化硫,Cu与浓硫酸反应需要加热,稀硝酸与硫酸钠不反应,60%硫酸与亚硫酸钾不需要加热可以得到二氧化硫,
故选:c;
(4)E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度;潮湿的氯气和二氧化硫反应生成HCl与硫酸,反应离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:饱和食盐水;SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(5)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏,标准状况下,896mlCl2为$\frac{0.896L}{22.4L/mol}$=0.04mol,故理论上可得到0.04molSO2Cl2,即为0.04×135g=5.4g,所以SO2Cl2的产为$\frac{4.2g}{5.4g}$×100%=77.8%,
故答案为:蒸馏;77.8%.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
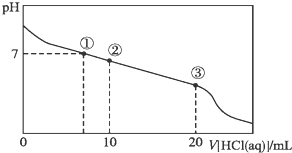
| A. | 点①所示溶液中,溶质为未反应完的CH3COONa、生成的CH3COOH和NaCl,微粒之间的关系为:c(CH3COOH)>c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中,醋酸钠有一半与盐酸反应,微粒之间的关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中,醋酸钠与盐酸恰好完全反应,微粒之间的关系为:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中有可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减压 | B. | 加压 | C. | 适当降温 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将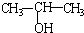 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸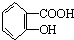 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 古文或谚语 | 化学解释 |
| A | 日照香炉生紫烟 | 碘的升华 |
| B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
| C | 煮豆燃豆萁 | 化学能转化为热能 |
| D | 雷雨肥庄稼 | 自然固氮 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com