
 矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.分析 (1)硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•SiO2•H2O,同时要遵循原子比例关系;
(2)根据化合价代数和为0确定x、y、m之间的关系;
(3)加入盐酸,充分溶解,过滤,将沉淀灼烧得固体4.80g为SiO2,根据Si元素守恒计算CaxMgySi8O22(OH)m的物质的量,进而计算其摩尔质量;
再空气中灼烧,减少质量为水的质量,计算水的物质的量,根据H元素守恒计算m的数值,再根据电荷守恒及摩尔质量列方程计算x、y的值,进而确定其化学式.
解答 解:(1)CaxMgySi8O22(OH)m改写成氧化物的形式为xCaO•yMgO•8SiO2•$\frac{m}{2}$H2O,故答案为:xCaO•yMgO•8SiO2•$\frac{m}{2}$H2O;
(2)根据电荷守恒有:2x+2y+4×8=22×2+m,整理得2x+2y-m=12,故答案为:2x+2y-m=12;
(3)n(SiO2)=4.8g÷60g•mol-1=0.08 mol,
CaxMgySi8O22(OH)m的摩尔质量M=8.10g÷(0.08 mol÷8)=810 g•mol-1,
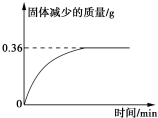
n(H2O)=0.36g÷18g•mol-1=0.02 mol,
16.2gCaxMgySi8O22(OH)m的物质的量为16.20g÷810 g•mol-1=0.02mol,
m=0.02 mol×2÷0.02mol=2
根据电荷守恒:2x+2y+4×8=22×2+2
整理得:x+y=7…①
40 x+24 y+28×8+16×22+17×2=810…②
由①、②式得:x=2 y=5
故化学式为:Ca2Mg5Si8O22(OH)2
答:该硅酸盐样品的化学式为Ca2Mg5Si8O22(OH)2.
点评 本题考查考查硅酸盐的性质、化学式的有关计算等,明确发生的反应是关键,是对基础知识的综合应用,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为$\frac{4}{15}$NA | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钙 熟石灰 CaO | D. | 氢氧化钠 火碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、CO、CO2均为酸性氧化物 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2的质子数相同,互为同位素 | |
| C. | 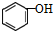 与 与 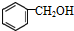 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S的电子式: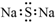 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: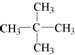 | |
| D. | 氯离子结构示意图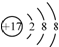 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com