
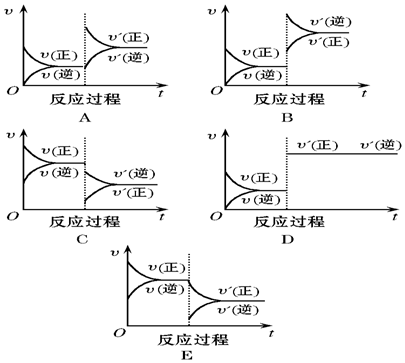
分析 (1)升温,正逆反应速率都加快,平衡向吸热反应方向移动,即逆反应方向移动;新平衡中C的体积分数减小;
(2)降压,正逆反应速率都减慢,平衡向气体体积增大的方向移动,即逆反应方向移动不;新平衡中A的转化率减小;
(3)减少C的量,瞬间生成物的浓度减小,逆反应速率减小,正反应速率不变,v正大于v逆;
(4)增加A的量,平衡正向移动,此时B的转化率增大,A的转化率减小;
(5)使用催化剂,正逆反应速率都加快,平衡不移动,A的转化率不变,C的质量分数不变;
(6)若维持容器内压强不变,充入氖气时,体积增大,相当于减小压强;
解答 解:(1)对反应A(g)+B(g)?C(g)(正反应为放热反应),升温,正逆反应速率都加快,平衡向吸热反应方向移动,即逆反应方向移动,所以图象B符合;新平衡中C的体积分数减小,故答案为:B;减小;
(2)降压,正逆反应速率都减慢,平衡向气体体积增大的方向移动,即逆反应方向移动,所以图象C符合;新平衡中A的转化率减小,故答案为:C;减小;
(3)减少C的量,瞬间生成物的浓度减小,逆反应速率减小,正反应速率不变,v正大于v逆,平衡向正反应方向移动,所以E符合,故答案为:E;
(4)增加A的量,平衡正向移动,所以图象A符合,此时B的转化率增大,A的转化率减小,故答案为:A;增大;减小;
(5)使用催化剂,正逆反应速率都加快,平衡不移动,所以图象D符合,则A的转化率不变,C的质量分数不变,故答案为:D;不变;不变;
(6)若维持容器内压强不变,充入氖气时,体积增大,相当于减小压强,平衡逆向移动,所以混合气体的颜色先变浅后变深,故答案为:变浅后变深.
点评 本题考查外界条件对化学平衡移动影响,为高频考点,正确理解外界条件对化学反应速率、化学平衡移动影响原理是解本题关键,注意:改变浓度瞬间,曲线与原曲线有相交点,如果改变的是催化剂,改变条件后反应速率曲线为直线,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
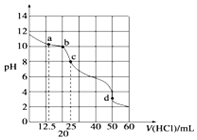 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 在海轮外壳上镶入锌块可减缓船体的腐蚀,是采用了牺牲阳极的阴极保护法 | |
| C. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com