
| A. | 是否有电子转移 | |
| B. | 同一元素的化合价在反应前后是否有变化 | |
| C. | 是否有氧元素参加 | |
| D. | 是否是化合反应或分解反应 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
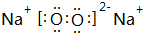 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | Na放入水中,产生气体:Na+H2O=Na++OH-+H2↑ | |
| C. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Mg2+ | |
| D. | 某溶液加NaOH溶液生成红褐色沉淀,说明原溶液中有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛肉 | B. | 白菜 | C. | 鸡蛋 | D. | 牛奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F>Na>Mg>Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<H3PO4<H2SO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com