
| A、标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA |
| B、7g CnH2n中含氢原子数为NA |
| C、78 g 过氧化钠与CO2反应,转移电子数为2NA |
| D、25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、1.1 mol |
| B、0.87 mol |
| C、0.8 mol |
| D、0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
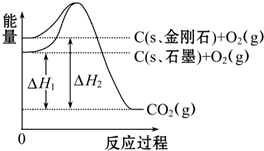
| A、C(s、石墨)═C(s、金刚石)△H=+1.9 kJ?mol-1 |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、1 mol石墨的能量比1 mol金刚石的总能量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
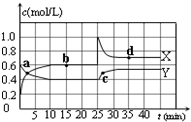 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 130℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 具有多种同素异形体,形成的化合物种类繁多 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 位于元素周期表金属与非金属元素的分界线上,最高化合价为+4 |
| W | 富集在海水中的元素,它的某些化合物常用作消毒刹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物M的球棍模型如图所示:
某有机物M的球棍模型如图所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com