
 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.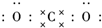 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.分析 (1)根据CO2为共价化合物书写电子式判断所含化学键;
(2)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
①根据盖斯定律①×2+②书写CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式;
②a.逆反应速率先增大后减小,说明平衡向逆反应方向移动;
b.H2的转化率增大,说明平衡向正反应方向移动;
c.CO2的体积百分含量减小,可能为减小二氧化碳的量使平衡向逆反应方向移动;
d.容器中c(H2)/c(CO2)的值减小,可能为减小氢气的量使平衡向逆反应方向移动;
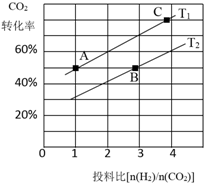
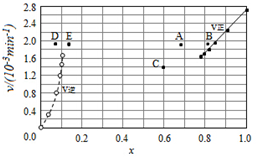
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6mol×60%×$\frac{1}{2}$=1.8mol,根据平均反应速率v(CH3OCH3)=$\frac{△c}{△t}$;根据平衡常数仅与温度有关比较KA、KB、KC三者之间的大小关系;
(3)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,越弱越水解判断;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}_{2}CO{\;}_{3})}{c(NH{\;}_{4}{\;}^{+})c(HCO{\;}_{3}{\;}^{-})}$=$\frac{c(H{\;}^{+})c(OH{\;}^{-})}{K(NH{\;}_{3}•H{\;}_{2}O)K{\;}_{1}}$进行计算.
解答 解:(1)因为CO2为共价化合物,则电子式为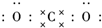 ,所含化学键为共价键,故答案为:
,所含化学键为共价键,故答案为: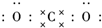 ;共价键;
;共价键;
(2)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
①根据盖斯定律①×2+②,则CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式为2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-122.7 kJ•mol-1,
故答案为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-122.7 kJ•mol-1;
②a.逆反应速率先增大后减小,说明平衡向逆反应方向移动,故不选;
b.H2的转化率增大,说明平衡向正反应方向移动,故选;
c.CO2的体积百分含量减小,可能为减小二氧化碳的量使平衡向逆反应方向移动,故不选;
d.容器中c(H2)/c(CO2)的值减小,可能为减小氢气的量使平衡向逆反应方向移动,故不选;
故选:b;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6mol×60%×$\frac{1}{2}$=1.8mol,所以平均反应速率v(CH3OCH3)=$\frac{△c}{△t}$=$\frac{\frac{1.8mol}{2L}}{5min}$0.18 mol.L-1min-1;又平衡常数仅与温度有关,所以KA=KC,又根据图象在相同投料比时T1温度下二氧化碳转化率大,所以T1温度下较T2温度下反应向正反应方向移动,则KA=KC>KB,
故答案为:0.18 mol.L-1min-1;KA=KC>KB;
(3)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}_{2}CO{\;}_{3})}{c(NH{\;}_{4}{\;}^{+})c(HCO{\;}_{3}{\;}^{-})}$=$\frac{c(H{\;}^{+})c(OH{\;}^{-})}{K(NH{\;}_{3}•H{\;}_{2}O)K{\;}_{1}}$=$\frac{10{\;}^{-14}}{1.75×10{\;}^{-5}×4.4×10{\;}^{-7}}$=1.3×10-3;
故答案为:碱性;1.3×10-3.
点评 本题考查化学平衡计算与影响因素、盖斯定律的应用,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握图象的分析,较好的考查学生对知识的迁移应用,难度中等.


科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
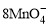 +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
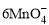 +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______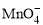 +______Fe2++______H+ =______Mn2++______Fe3++___
+______Fe2++______H+ =______Mn2++______Fe3++___ ___H2O
___H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2 H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.用石墨电极电解饱和食盐水:2 Cl-+2 H2O  2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3++2 I-===2 Fe2++I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生氧化反应 D.Cl2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
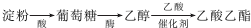
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
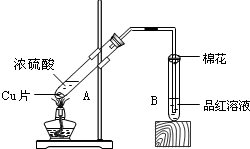 某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:
某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
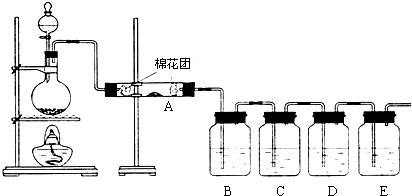
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
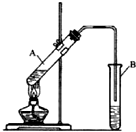 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com