
【题目】有铜和氧化铁的混合物ag,当慢慢滴入![]() 的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
A.等于![]()
![]() B.大于
B.大于![]()
![]()
C.大于![]() D.等于
D.等于![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫的化合物丰富多彩,且都有一定的用途。
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,S2Cl2的电子式为________。S2Cl2遇水很容易发生水解反应生成一种淡黄色固体和两种气体,其反应的化学方程式为__________________________________。
(2)用作氧化剂的过二硫酸铵[(NH4)2S2O8]属于离子化合物,易溶于水,其可由硫酸铵[(NH4)2SO4]为原料制备。
①(NH4)2SO4溶液呈酸性的原因是________________________(用离子方程式表示),(NH4)2SO4溶液中各种离子的浓度由大到小的顺序为________________________。
②若硫酸铵溶液的浓度为250 g·L-1,其物质的量浓度是________mol·L-1。
③(NH4)2S2O8在Ag+的催化作用下能将Mn2+氧化成MnO![]() ,其反应的离子方程式为__________________________________________________________________。
,其反应的离子方程式为__________________________________________________________________。
(3)Na2S2O4在空气分析中常用来吸收氧气,当吸收氧气、水蒸气后发生反应时,若还原剂和氧化剂的物质的量之比为1∶1,则产物为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是

A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
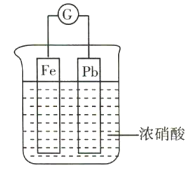
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )

A.常温下,能与Na2CO3溶液反应放出CO2
B.1mol M最多能与2mol Br2发生反应
C.M与足量的NaOH溶液反应时,所得有机产物的化学式为C9H4O5Na4
D.该有机物不能使FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是
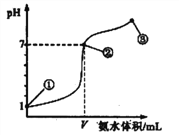
A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() 的
的![]() 二元酸的正盐
二元酸的正盐![]() 溶液中含A原子的粒子所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
溶液中含A原子的粒子所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )

A.NaHA溶液显碱性
B.![]() 时,
时,![]()
C.![]() 时,
时,![]()
D.室温下,![]() 的电离平衡常数
的电离平衡常数![]() 为
为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表第四周期共有18种元素。回答下列问题:
(l)第四周期元素的基态原子中,最高能层中的s轨道上只有一个电子的元素有_____;
镍元素基态原子的电子排布式为____;p区元素第一电离能由大到小的前三种元素依次为____;
(2)GaBr3、GeBr4、AsBr3、AsBr5中,中心原子的轨道杂化类型为sp3的化合物是____;分子的立体构型为平面三角形的化合物是_____;AsBr5的分子构型为 ,则AsBr5是_____(填“极性”或“非极性”)分子。
,则AsBr5是_____(填“极性”或“非极性”)分子。
(3)已知GaF3的沸点为19.5℃、GaC13的沸点为201.3℃、GaBr3的沸点为292℃,导致沸点如此变化的原因是___________.
(4)Ca、CaO、CaC12等含钙物质的焰色均为砖红色,焰色形成的原因是钙元素在一定条件下产生原子_______光谱。CaO晶胞如图所示,CaO晶体中Ca2+的配位数为____;若CaO的密度为dg/cm3,则CaO的晶胞参数a=__________nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com