
分析:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-.结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(NH4+),据此解答.
解答:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;
加入NaOH溶液,产生白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-;
由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;
第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol;
最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;
第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)÷2=0.05mol,
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A错误;
B.由上述分析可知,溶液中n(NH4+)=0.2mol,故B正确;
C.由上述分析可知,溶液中一定不含CO32-、NO3-,一定含有SO42-,故C错误;
D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误,
故选B.
点评:本题考查离子共存、反应图象识别以及离子反应有关计算等,是高考中的常见题型,对学生的综合能力提出了更高的要求,有利于培养学生的逻辑思维能力和发散思维能力,难度较大.


科目:高中化学 来源: 题型:
海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如反渗透法、电渗析法、离子交换法等,下列方法中也是用来进行海水淡化的是( )
|
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3;3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是 ,第一电离能最小的元素是.
(2)基态氮原子的L层电子排布图为 .
(3)与N3﹣互为等电子体的分子为 (写出一种).依据价层电子对互斥理论,NO3﹣的空间构型为 .
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为 .叠氮化钠的水溶液呈碱性,用离子方程式表示其原因: .
(5)N2O沸点(﹣88.49℃)比NH3沸点(﹣33.34℃)低,其主要原因是 .
(6)安全气囊的设计原理为6NaN3+Fe2O3 3Na2O+2Fe+9N2↑.
3Na2O+2Fe+9N2↑.
①氮分子中σ键和π键数目之比为 .
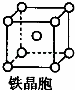
②铁晶体中存在的化学键类型为 .
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为 3 (用含a、NA的表达式表示,其中NA为阿伏加德罗常数).
查看答案和解析>>
科目:高中化学 来源: 题型:
巴豆酸的结构简式为CH3﹣CH=CH﹣COOH,现有①氯化氢 ②溴水 ③纯碱溶液④2﹣丙醇 ⑤酸化的高锰酸钾溶液.试根据其结构特点判断在一定条件下能与巴豆酸反应的物质组合是( )
A. 只有②④⑤ B. 只有①③④ C. 只有①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃A的相对分子质量为84.回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) .
a.C7H12O2;b.C6H14;c.C6H14O;d.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种.
①A的结构简式为 ;
②链烃A与Br2的CCl4溶液反应生成B,B与NaOH的醇溶液共热可得到D,D分子中无溴原子.请写出由B制备D的化学方程式: ;
③B与足量NaOH水溶液完全反应,生成有机物E,该反应的化学方程式: ;E与乙二醇的关系是 .
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为 .
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO﹣3、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验
①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
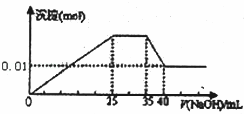
A. 原溶液一定不存在H+、Cu2+、CO32﹣
B. 不能确定原溶液是否含有K+、NO3﹣
C. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D. 实验所加的NaOH的浓度为2 mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组鉴别甲的过程与现象如图所示(已知甲是一种盐).下列结论正确的是( )

A. 如果甲中含有S2﹣,则乙是硫磺沉淀
B. 如果乙是AgCl沉淀,那么甲是FeCl3
C. 丙中肯定含有Fe3+,所以甲是FeBr2
D. 甲中含有铁元素,可能显+2价或+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
(i) I2(g)+H2(g)⇌2HI(g)+9.48kJ
(ii) I2(S)+H2(g)⇌2HI(g)﹣26.48kJ
下列判断正确的是()
A. 254g I2(g )中通入2gH2(g),反应放热9.48 kJ
)中通入2gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 |
|
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 |
|
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 |
|
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com